Автор: Денис Аветисян
Новый подход, объединяющий квантовые вычисления и молекулярную динамику, позволяет предсказывать ключевые участки гидратации белков, что открывает перспективы для более эффективной разработки лекарственных препаратов.
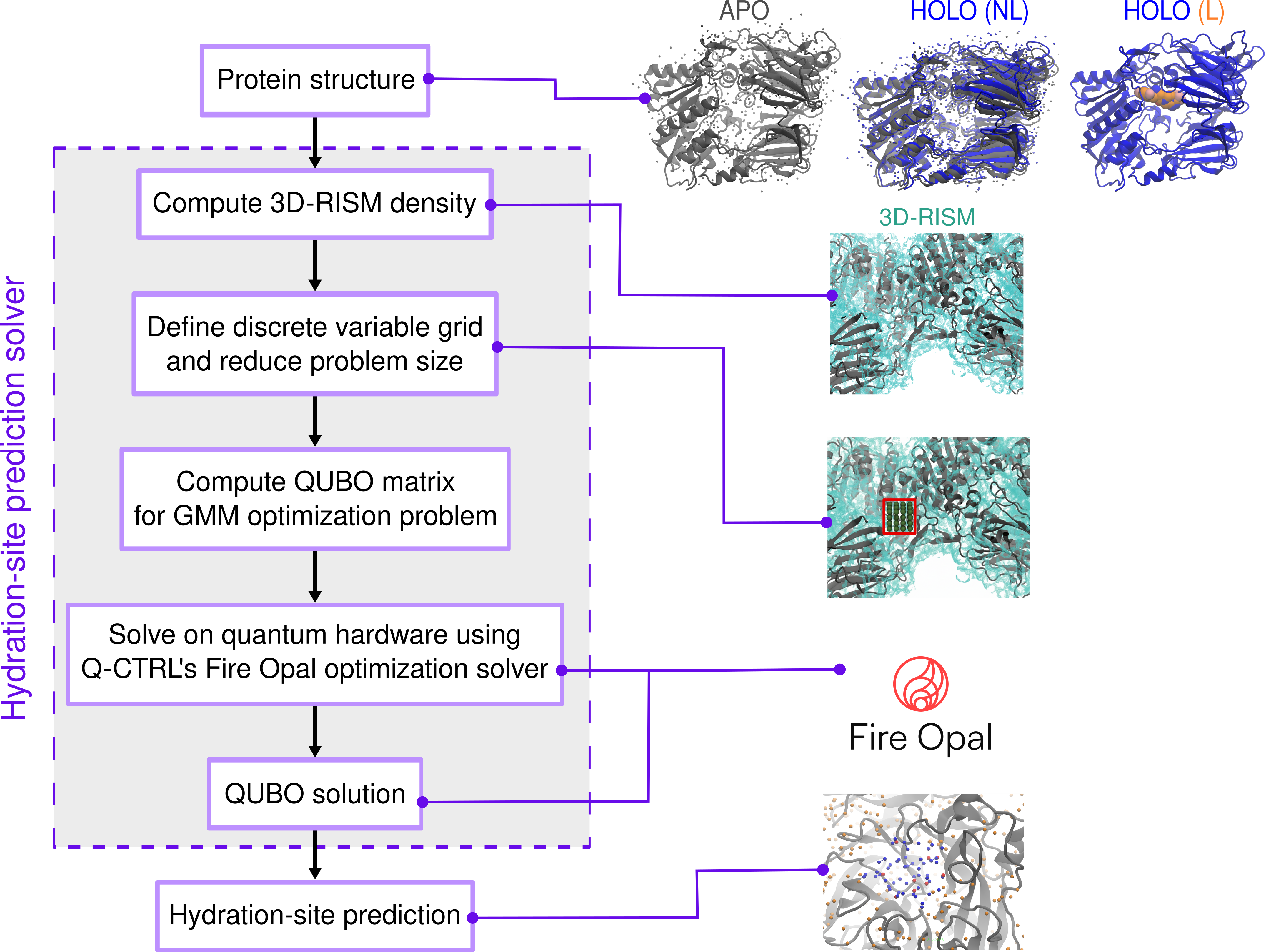
Исследователи применили оптимизацию QUBO в сочетании с 3D-RISM для точного определения сайтов гидратации в белках, что может значительно улучшить пайплайн разработки лекарств.
Несмотря на значительный прогресс в вычислительной химии, точное предсказание гидратационных сайтов в белках остается сложной задачей, критически важной для разработки лекарств. В работе, озаглавленной ‘Practical protein-pocket hydration-site prediction for drug discovery on a quantum computer’, представлен новый подход, объединяющий квантовый отжиг и классическое 3D-RISM моделирование для решения задачи оптимизации размещения молекул воды в белковых карманах. Показано, что предложенный метод демонстрирует сопоставимую с классическими подходами точность, а также потенциал для улучшения результатов с увеличением количества кубитов, открывая перспективы для более эффективного скрининга и оптимизации потенциальных лекарственных средств. Возможно ли, что квантовые вычисления смогут преодолеть ограничения классических методов в моделировании сложных биомолекулярных систем?
Точность гидратации: Ключевой вызов в разработке лекарств
Точное предсказание участков гидратации вокруг белков имеет фундаментальное значение для понимания их функционирования и разработки эффективных лекарственных препаратов. Вода, взаимодействуя с белками, оказывает значительное влияние на их структуру, стабильность и способность связываться с другими молекулами, включая потенциальные лекарства. Неправильное определение этих участков гидратации может привести к неверной интерпретации механизмов действия белка и, как следствие, к разработке неэффективных или даже вредных препаратов. Поэтому, создание надежных методов для картирования водной оболочки вокруг белков является критически важной задачей в современной биофармацевтике, способствующей более рациональному и успешному проектированию лекарственных средств, нацеленных на специфические белковые мишени.
Традиционные вычислительные методы, такие как молекулярная динамика, несмотря на свою широкую распространенность, сталкиваются с серьезными ограничениями при моделировании гидратации белков. Основная проблема заключается в огромных вычислительных затратах, необходимых для адекватного исследования всех возможных конфигураций молекул воды вокруг белковой поверхности. Даже для относительно небольших систем, точное и полное моделирование требует значительных временных и аппаратных ресурсов. Кроме того, классические алгоритмы молекулярной динамики часто не способны эффективно преодолеть энергетические барьеры, что приводит к недостаточному охвату конформационного пространства воды и, как следствие, к неточным предсказаниям о расположении и взаимодействии молекул воды с белком. Это особенно критично для выявления слабых, но важных взаимодействий, определяющих стабильность белковой структуры и ее функциональную активность, что значительно затрудняет процесс разработки лекарственных препаратов.
Ограничения в точном определении мест гидратации вокруг белков существенно замедляют процессы компьютерного моделирования лекарственных препаратов (CADD) и, как следствие, увеличивают затраты на разработку новых лекарств. Трудность заключается в том, что полное выявление молекул воды, присутствующих в кристаллической структуре белка (достижение значений $C$, близких к 1), остается сложной задачей. Неточное определение этих молекул воды может привести к неверному пониманию взаимодействия белка с потенциальными лекарственными соединениями и, в конечном итоге, к разработке неэффективных препаратов. Поэтому, повышение точности и скорости определения мест гидратации является критически важным шагом для оптимизации CADD и снижения финансовых издержек в фармацевтической индустрии.

>) и эффективность идентификации кристаллических молекул воды (C), при этом параметры дискретизации 3D-RISM плотности влияют на средний размер кластеров (<
3D-RISM: Моделирование сложного взаимодействия воды
Метод 3D-RISM предоставляет возможность вычисления непрерывной плотности воды вокруг молекулы, что позволяет детально изучать участки гидратации. В отличие от дискретных моделей, 3D-RISM вычисляет электронную плотность воды в каждой точке пространства вокруг анализируемой молекулы, обеспечивая более точное представление о структуре гидратной оболочки. Эта непрерывная плотность, выраженная в единицах $m^{-3}$, позволяет идентифицировать как прямые, так и косвенные взаимодействия между молекулой и водой, а также оценивать энергию этих взаимодействий. Детализация, предоставляемая методом, критически важна для понимания процессов, зависящих от гидратации, таких как сворачивание белков, молекулярное распознавание и катализ.
Точность метода 3D-RISM напрямую зависит от адекватного представления распределения плотности воды вокруг молекулы. Для аппроксимации этого распределения часто используется Гауссова смесь моделей (GMM). GMM представляет собой параметрическое представление, где распределение плотности моделируется как взвешенная сумма гауссовых функций. Каждая гауссова функция характеризуется своим центром, ковариационной матрицей и весом, что позволяет GMM эффективно описывать сложные и неоднородные распределения плотности воды, возникающие из-за различных взаимодействий между молекулами воды и растворенными веществами. Выбор параметров GMM, таких как количество гауссовых компонентов и их начальные значения, существенно влияет на точность моделирования.
Метод 3D-RISM обеспечивает физически обоснованный подход к моделированию взаимодействия молекул, поскольку опирается на детальное понимание как структуры белков, так и поведения молекул воды. Точность моделирования напрямую зависит от корректного учета этих факторов. Оценка эффективности метода производится с использованием метрик, таких как усредненная точность ($⟨P⟩$), значение которой стремится к 1 при успешном прогнозировании местоположения и структуры молекул воды вокруг белка. Высокие значения $⟨P⟩$ свидетельствуют о корректном воспроизведении физической картины гидратации и позволяют надежно предсказывать взаимодействие белков с растворителем.
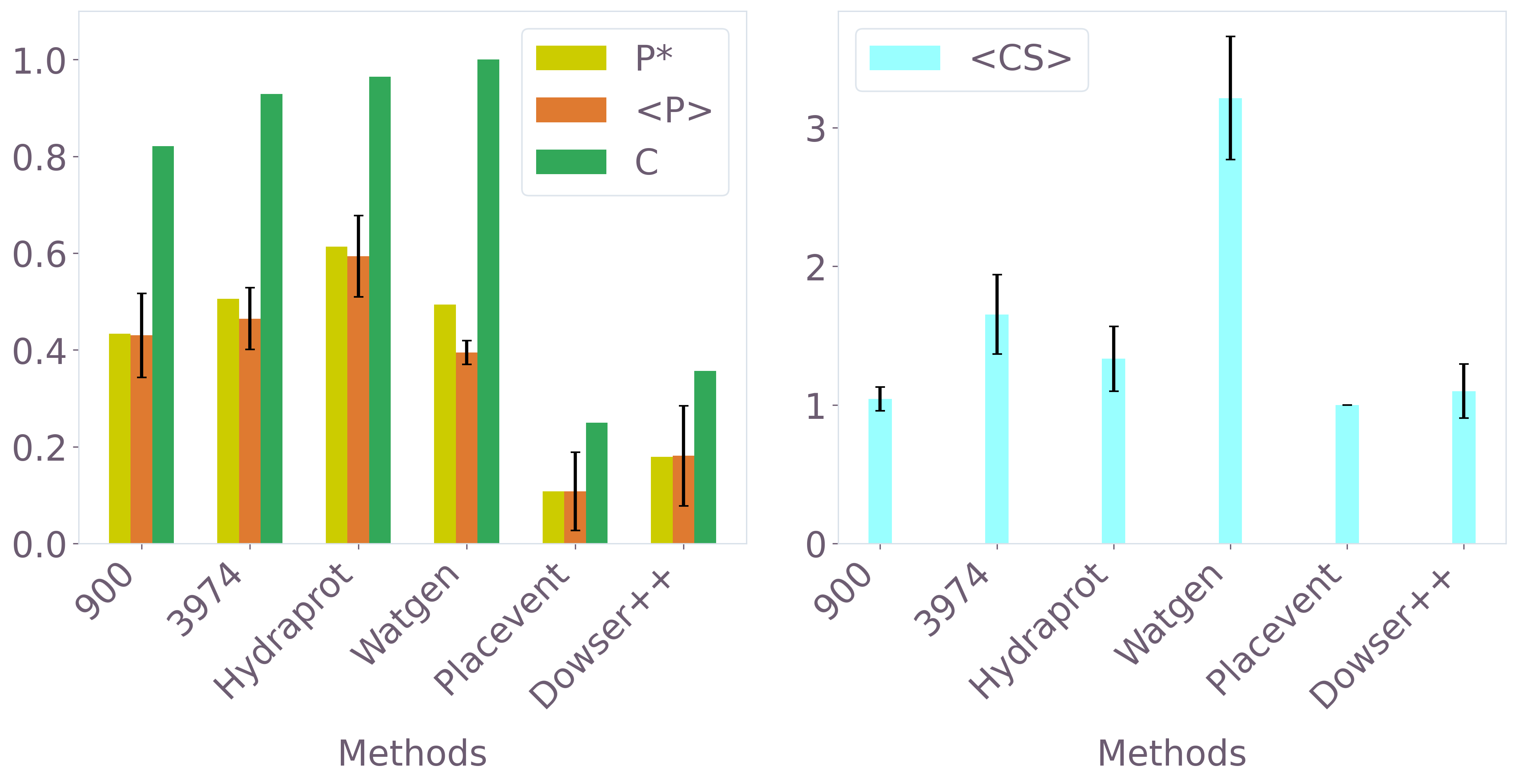
>), долю идентифицированных кристаллических молекул воды (C) и средний размер кластеров (<
От классической к квантовой оптимизации в предсказании гидратации
Формулировка задачи предсказания участков гидратации в виде задачи квадратичной неограниченной двоичной оптимизации (QUBO) позволяет использовать широкий спектр эффективных алгоритмов оптимизации. В рамках QUBO, каждая потенциальная точка гидратации представляется бинарной переменной, принимающей значение 0 или 1, обозначающее отсутствие или наличие водной оболочки соответственно. Энергия взаимодействия между молекулами воды и растворителем, а также между самими молекулами воды, кодируется в виде квадратичной функции этих бинарных переменных. Это позволяет свести задачу к минимизации этой функции, используя как классические методы, такие как Simulated Annealing или методы ветвей и границ, так и современные квантовые алгоритмы, такие как Quantum Approximate Optimization Algorithm (QAOA). Такое представление обеспечивает гибкость и масштабируемость решения, что особенно важно для сложных систем с большим количеством потенциальных участков гидратации.
Формулировка задачи предсказания сайтов гидратации в виде задачи квадратичной неограниченной двоичной оптимизации (QUBO) обеспечивает возможность применения квантового приближенного алгоритма оптимизации (QAOA) для получения эффективных решений. Расчеты 3D-RISM, предоставляющие информацию о структуре жидкости, генерируют данные, которые кодируются в QUBO. Эта формулировка позволяет преобразовать сложную физическую задачу в математическую, пригодную для решения с использованием квантовых алгоритмов, таких как QAOA. Использование QUBO как промежуточного представления облегчает связь между классическими методами расчета свойств растворителей и потенциальным использованием квантовых вычислений для ускорения процесса предсказания сайтов гидратации.
Для оценки потенциального ускорения, обеспечиваемого квантовыми вычислениями, задача предсказания участков гидратации, сформулированная как задача квадратичной неограниченной двоичной оптимизации (QUBO), решается также классическими методами оптимизации. Используемые экземпляры QUBO содержат приблизительно 100 000 двухкубитных вентилей, что представляет собой масштаб, при котором ожидается проявление квантового преимущества. Сравнение результатов, полученных классическими и квантовыми алгоритмами на данных экземплярах, позволяет оценить эффективность и скорость работы квантовых методов в контексте данной задачи.
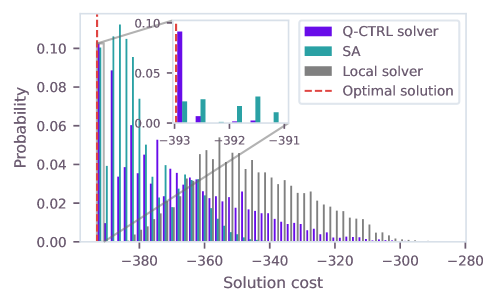
Подавление квантовых ошибок и путь к практической полезности
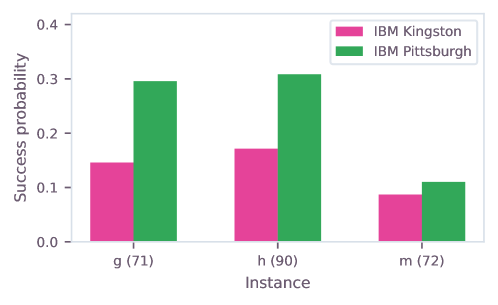
Для получения достоверных результатов на шумных квантовых процессорах, таких как IBM Heron, критически важно внедрение методов подавления ошибок. Технологии, предлагаемые Q-CTRL Fire Opal, позволяют значительно снизить влияние нежелательных шумов и декогеренции, которые неизбежно возникают в процессе квантовых вычислений. Эти методы активно борются с ошибками, возникающими из-за несовершенства аппаратного обеспечения и внешних воздействий, позволяя поддерживать когерентность кубитов на протяжении более длительного времени и, следовательно, выполнять более сложные и точные вычисления. Без эффективного подавления ошибок, даже самые мощные квантовые процессоры могут выдавать неверные или случайные результаты, что делает их непригодными для практических задач.
Посредством снижения погрешностей в алгоритме QAOA (Quantum Approximate Optimization Algorithm) открывается возможность достижения квантического ускорения в задаче предсказания сайтов гидратации. Эта методика позволяет более эффективно определять места связывания молекул воды с биологическими макромолекулами, что критически важно для моделирования и разработки лекарственных препаратов. Уменьшение ошибок в процессе квантовых вычислений позволяет алгоритму QAOA находить более точные решения, сокращая время, необходимое для выявления ключевых структурных особенностей, определяющих взаимодействие с водой. Это, в свою очередь, значительно повышает надежность и эффективность моделирования, позволяя исследователям более точно прогнозировать поведение молекул и разрабатывать новые, более эффективные лекарственные средства. В результате, смягчение влияния ошибок становится необходимым условием для реализации практического преимущества квантовых вычислений в области биомолекулярных исследований.
В конечном итоге, применяемый подход выходит за рамки существующих возможностей, открывая путь к достижению Квантовой Полезности в конвейерах разработки лекарственных препаратов. Успешное подавление ошибок в алгоритмах, таких как QAOA, позволяет значительно улучшить точность предсказания местоположения молекул воды вокруг целевых белков — критически важного этапа в понимании взаимодействия лекарственных средств с биологическими системами. Эффективность данного метода оценивается с помощью среднего размера кластера ($⟨CS⟩$), который отражает степень распространения предсказанных молекул воды и, следовательно, точность моделирования гидратной оболочки. Более крупные и согласованные кластеры указывают на более точное предсказание, что потенциально ускоряет процесс открытия новых лекарств и оптимизирует их эффективность.
Представленное исследование демонстрирует элегантность подхода к сложной задаче — предсказанию гидратационных сайтов в белках для ускорения разработки лекарств. Комбинация квантовых вычислений и метода 3D-RISM позволяет оптимизировать поиск этих критически важных участков, влияющих на взаимодействие белка с лекарственным средством. Этот метод, подобно хорошо спроектированной системе, работает незаметно, пока не возникает потребность в точном определении этих сайтов. Как говорил Ричард Фейнман: «Если вы не можете объяснить что-то простыми словами, значит, вы сами этого не понимаете». Подобная простота и ясность принципов лежат в основе эффективной архитектуры, а хорошая архитектура незаметна, пока не ломается, и только тогда видна настоящая цена решений.
Куда двигаться дальше?
Представленная работа, безусловно, демонстрирует элегантность подхода — попытку свести сложную биофизическую задачу к оптимизации в рамках квантовых вычислений. Однако, необходимо признать, что предсказание гидратационных сайтов — лишь один аспект взаимодействия лиганда с белком. Устойчивость предсказаний, полученных посредством QUBO и 3D-RISM, требует дальнейшей проверки на более широком спектре белковых структур и в различных условиях. Настоящий вызов заключается не только в увеличении точности, но и в интеграции этого метода в существующие пайплайны разработки лекарств, где скорость и стоимость играют решающую роль.
Следующим логичным шагом представляется расширение модели для учета динамики белковых конформаций. Статичная картина гидратационных сайтов упрощает реальность, игнорируя флуктуации, которые могут существенно влиять на связывание лиганда. Включение элементов молекулярной динамики в оптимизационный процесс, пусть и с неизбежным увеличением вычислительной сложности, представляется необходимым. Иначе, мы рискуем создать красивую, но нежизнеспособную систему.
И, наконец, стоит задуматься о фундаментальных ограничениях самого подхода. Упрощение белковой среды до бинарной оптимизации — это всегда компромисс. Поиск баланса между точностью и вычислительной эффективностью — вечная дилемма. По-настоящему прорывные решения, вероятно, потребуют переосмысления самой парадигмы моделирования белковых взаимодействий, а не просто улучшения существующих алгоритмов.
Оригинал статьи: https://arxiv.org/pdf/2512.08390.pdf
Связаться с автором: https://www.linkedin.com/in/avetisyan/
Смотрите также:
- Функциональные поля и модули Дринфельда: новый взгляд на арифметику
- Квантовая самовнимательность на службе у поиска оптимальных схем
- Квантовый Борьба: Китай и США на Передовой
- Квантовые нейросети на службе нефтегазовых месторождений
- Интеллектуальная маршрутизация в коллаборации языковых моделей
- Квантовый скачок: от лаборатории к рынку
2025-12-10 21:20