Автор: Денис Аветисян
В статье представлена система SAGE, объединяющая возможности компьютерной патологии и молекулярных данных для выявления и валидации биомаркеров, способных улучшить диагностику и лечение.
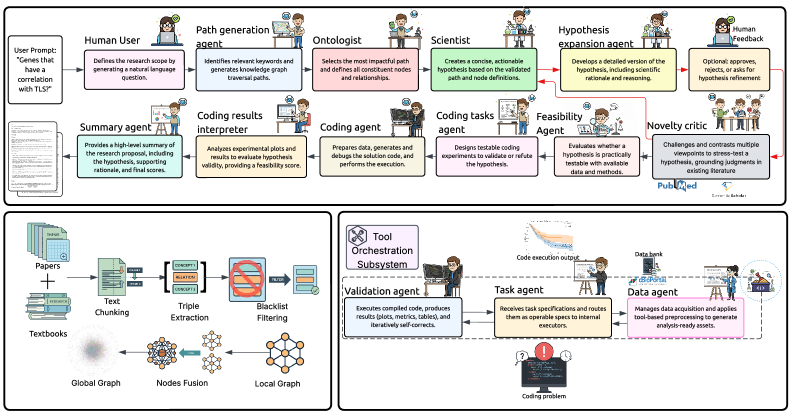
Предлагается структурированная агентная система для интерпретируемого обнаружения и клинической валидации биомаркеров в цифровой патологии.
Несмотря на значительный прогресс в области вычислительной патологии, многие модели искусственного интеллекта остаются «черными ящиками», затрудняя их внедрение в клиническую практику из-за недостаточной прозрачности. В данной работе представлена система SAGE (Structured Agentic system for hypothesis Generation and Evaluation), представляющая собой агентный фреймворк для интерпретируемого и клинически релевантного поиска биомаркеров в патологии. SAGE объединяет анализ мультимодальных данных с рассуждениями, основанными на литературных знаниях, для выявления корреляций между визуальными признаками, молекулярными биомаркерами и клиническими исходами. Способна ли подобная система, основанная на структурированном подходе и биологическом обосновании, существенно ускорить трансляцию вычислительной патологии в клиническую реальность?
Раскрытие Сложностей: Вызовы Поиска Биомаркеров
Традиционные методы поиска биомаркеров рака мочевого пузыря сталкиваются с существенными трудностями, обусловленными сложностью микроокружения опухоли и ограниченной пропускной способностью аналитических систем. Микроокружение, состоящее из разнообразных клеток, сосудов и внеклеточного матрикса, создает гетерогенную среду, где опухолевые клетки взаимодействуют сложным образом. Это взаимодействие затрудняет выявление универсальных биомаркеров, поскольку экспрессия белков и другие молекулярные характеристики могут значительно варьироваться в разных областях опухоли. Кроме того, существующие аналитические платформы часто не способны обрабатывать большие объемы данных, необходимые для адекватной оценки гетерогенности опухоли, что ограничивает возможность выявления надежных и информативных биомаркеров для диагностики, прогнозирования и мониторинга лечения рака мочевого пузыря.
Анализ цельных гистологических срезов в онкологии представляет собой сложную задачу, требующую применения усовершенствованных методик для преодоления присущей тканям неоднородности и субъективности интерпретации. Традиционные подходы часто сталкиваются с трудностями при выделении значимых сигналов из-за вариабельности клеточного состава и архитектуры опухоли, что затрудняет точную диагностику и прогнозирование. Современные исследования направлены на разработку алгоритмов машинного обучения и искусственного интеллекта, способных автоматически идентифицировать и количественно оценивать ключевые морфологические характеристики, минимизируя влияние человеческого фактора и повышая объективность оценки. Использование методов цифровой патологии и анализа изображений позволяет не только визуализировать сложные структуры тканей, но и извлекать из них ценную информацию, открывая новые возможности для персонализированной медицины и разработки эффективных стратегий лечения.
Современные подходы к изучению онкологических заболеваний часто сталкиваются с трудностями при объединении различных типов данных — геномных, протеомных и изображений. Это затрудняет получение полного представления о механизмах развития болезни, поскольку каждый тип данных предоставляет лишь частичную информацию. Например, геномные данные могут указать на генетические мутации, протеомные — на изменения в экспрессии белков, а изображения — на структурные особенности опухоли. Однако, чтобы понять, как эти факторы взаимодействуют и влияют на прогрессирование заболевания, необходима их интеграция. Отсутствие эффективных методов для объединения этих разнородных данных препятствует разработке точных диагностических инструментов и эффективных стратегий лечения, ограничивая возможности персонализированной медицины в онкологии.
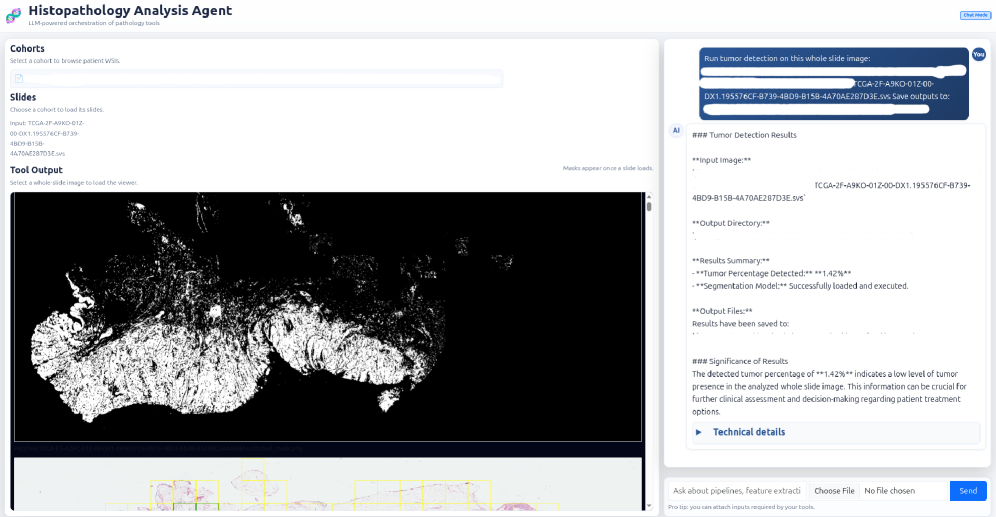
SAGE: Интеллектуальный Агент для Автоматизированных Открытий
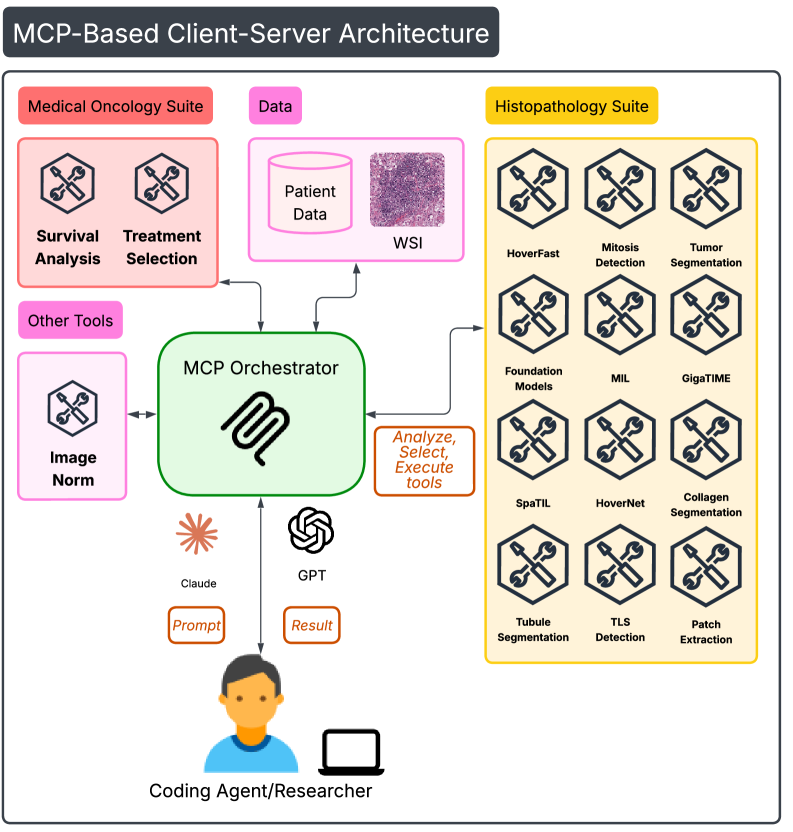
Система SAGE использует многоагентную архитектуру, в которой отдельные агенты, специализирующиеся на конкретных задачах, координируются для достижения общей цели. Такая структура позволяет эффективно распределять вычислительные ресурсы и упрощает масштабирование системы. В частности, агенты отвечают за построение биомедицинского графа знаний и генерацию гипотез, выполняя эти процессы независимо и параллельно. Координация между агентами осуществляется посредством обмена информацией и запросами, что позволяет системе динамически адаптироваться к изменяющимся требованиям и доступным данным. Разделение задач на специализированные агенты повышает надежность и упрощает отладку, поскольку каждая компонента может быть протестирована и оптимизирована независимо.
В основе системы SAGE лежит создание биомедицинского графа знаний, построенного с использованием модели GPT-4o-mini для извлечения связей из научной литературы. Процесс извлечения отношений базируется на анализе текстовых данных и идентификации ключевых взаимодействий между биологическими сущностями, такими как гены, белки и заболевания. Для обеспечения структурированности и семантической согласованности, граф знаний интегрирует базовую онтологию, определяющую типы сущностей и отношений, что позволяет осуществлять более точный и надежный анализ данных и автоматическое формирование гипотез.
В системе SAGE автоматическое формирование гипотез осуществляется на основе построенного биомедицинского графа знаний с использованием больших языковых моделей (LLM). Для повышения точности рассуждений применяется техника негативного промптинга, позволяющая исключить нежелательные или нерелевантные факторы. В ходе тестирования было установлено, что SAGE обеспечивает снижение использования токенов на 65% по сравнению с архитектурой, использующей общую память, что свидетельствует об эффективном управлении контекстом и снижении вычислительных затрат.
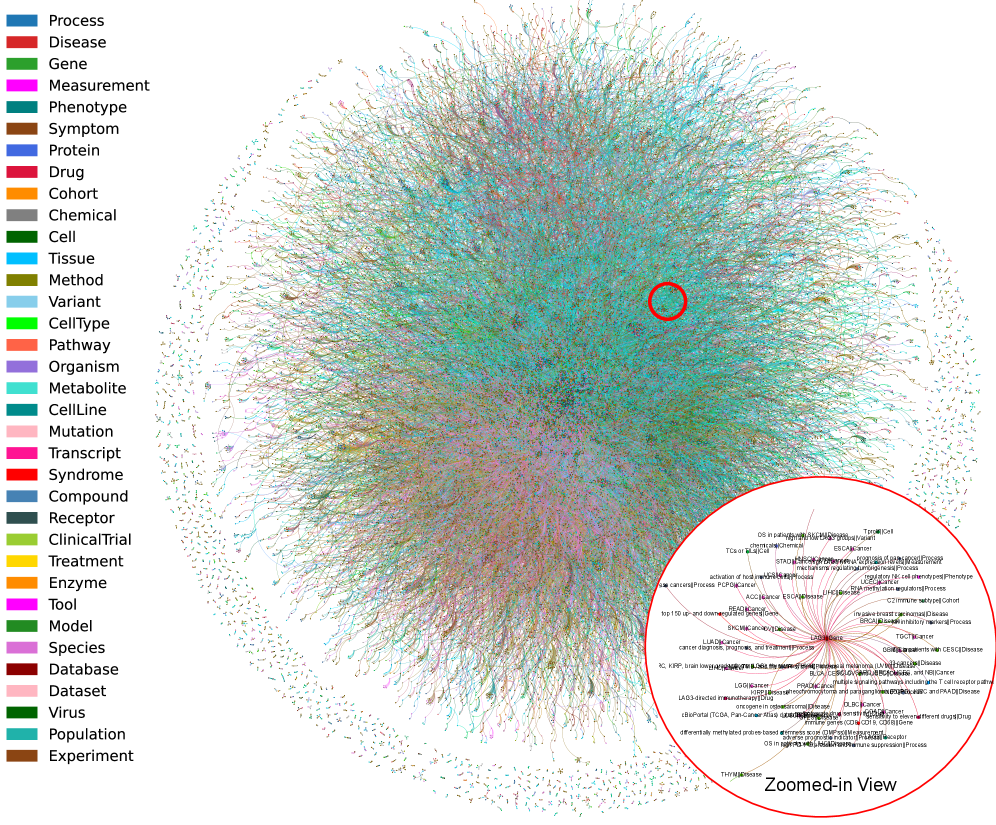
Автоматизированная Валидация и Идентификация Биомаркеров
Система SAGE использует подсистему оркестровки инструментов для автоматизации процесса валидации гипотез, интегрируя общепринятые статистические методы, такие как анализ выживаемости и модель пропорциональных рисков Кокса. Автоматизация включает в себя последовательное применение статистических тестов к данным, что позволяет оценить значимость потенциальных биомаркеров и их связь с клиническими исходами. Данный подход позволяет снизить субъективность и повысить воспроизводимость результатов валидации, а также ускорить процесс выявления перспективных кандидатов для дальнейшего исследования. Использование стандартизированных статистических методов обеспечивает надежность и интерпретируемость полученных данных.
Для обеспечения достоверности и клинической значимости идентифицированных биомаркеров, система SAGE использует данные из набора TCGA-BLCA (The Cancer Genome Atlas — Bladder Cancer) и изображения цельных гистологических срезов. Набор TCGA-BLCA предоставляет геномные данные и информацию о выживаемости пациентов, что позволяет установить корреляцию между экспрессией биомаркеров и клиническими исходами. Анализ цельных гистологических срезов, в свою очередь, обеспечивает визуальное подтверждение и контекстную информацию о локализации и экспрессии биомаркеров в ткани опухоли, что критически важно для подтверждения их релевантности.
Автоматизированный конвейер SAGE успешно идентифицировал E-FABP и TLS в качестве потенциальных биомаркеров рака мочевого пузыря, продемонстрировав способность системы к приоритизации кандидатов для дальнейшего исследования. Оценка новизны, проведенная SAGE, показала высокую степень согласования с оценками экспертов: коэффициент корреляции Пирсона составил 0.91, а коэффициент ранговой корреляции Спирмена — 0.89. Средняя абсолютная ошибка (MAE) составила 0.31, что указывает на тесное соответствие экспертным суждениям, а общая частота ошибок в оценочном наборе данных составила 8.7%.
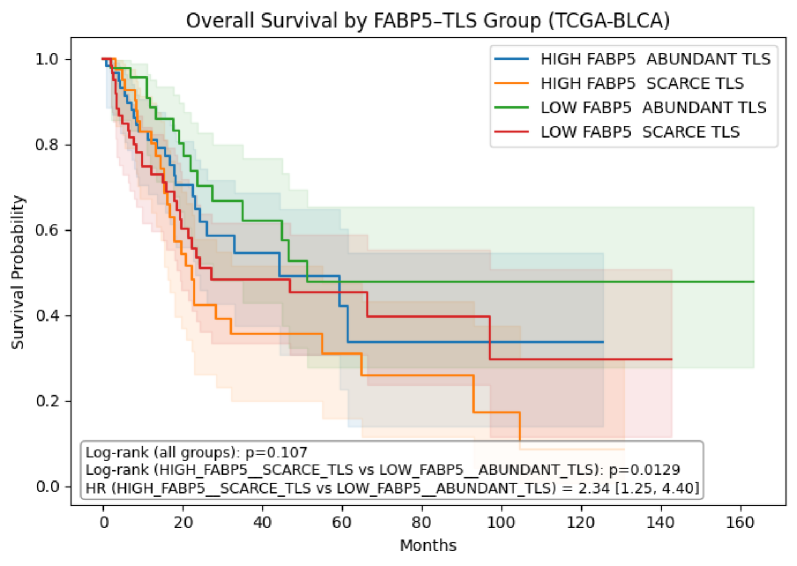
Клинический Перевод и Расширение Областей Применения
Клиническая валидация выявленных биомаркеров с использованием датасета TCGA-BLCA представляет собой важнейший этап на пути к персонализированной медицине при раке мочевого пузыря. Использование обширного и тщательно аннотированного набора данных TCGA-BLCA позволяет оценить прогностическую и диагностическую значимость потенциальных биомаркеров в реальных клинических сценариях. Проверка корреляции между выявленными биомаркерами и клиническими данными, такими как стадия заболевания, ответ на терапию и общая выживаемость, необходима для определения их практической ценности. Успешная валидация позволит разрабатывать более точные диагностические тесты и индивидуализированные схемы лечения, направленные на повышение эффективности терапии и улучшение прогноза для пациентов с раком мочевого пузыря.
Автоматизированный конвейер SAGE значительно сокращает временные и финансовые затраты, связанные с поиском биомаркеров. Традиционно, выявление надежных биомаркеров требовало трудоемких и дорогостоящих ручных анализов, занимающих месяцы или даже годы. SAGE, напротив, позволяет проводить комплексный анализ данных геномной экспрессии и выявлять потенциальные биомаркеры в сжатые сроки, что существенно ускоряет переход от фундаментальных исследований к клинической практике. Это особенно важно для онкологии, где своевременная диагностика и персонализированный подход к лечению играют ключевую роль в повышении эффективности терапии и улучшении прогноза для пациентов. Благодаря автоматизации, исследователи получают возможность сосредоточиться на валидации полученных результатов и разработке новых методов диагностики и лечения, а не на рутинных задачах по обработке данных.
Архитектура SAGE, разработанная как модульная система, демонстрирует значительный потенциал для расширения возможностей автоматизированных исследований за пределы онкологии мочевого пузыря. Эта гибкость достигается благодаря возможности легкой адаптации отдельных компонентов системы к новым наборам данных и специфическим вопросам, возникающим в различных областях биомедицины. Модульность позволяет исследователям оперативно переконфигурировать SAGE для изучения других заболеваний, от нейродегенеративных расстройств до сердечно-сосудистых заболеваний, существенно сокращая время и ресурсы, необходимые для выявления новых биомаркеров и разработки инновационных терапевтических стратегий. Таким образом, SAGE представляется не просто инструментом для анализа данных по раку мочевого пузыря, а универсальной платформой для проведения автоматизированных, гипотезо-ориентированных исследований в широком спектре биомедицинских дисциплин.
Представленная работа демонстрирует подход к выявлению биомаркеров, который, по сути, представляет собой эволюцию систем анализа данных. Система SAGE, объединяя вычислительную патологию с молекулярными данными и клиническими исходами, создает среду, в которой знания не просто накапливаются, но и взаимодействуют, формируя новые гипотезы. Этот процесс напоминает естественный отбор, где наиболее релевантные биомаркеры проявляются благодаря постоянному тестированию и валидации. Как однажды заметил Карл Фридрих Гаусс: «Не важно, насколько сложна система, всегда можно найти способ её описать». В данном случае, SAGE стремится упростить сложную реальность клинической патологии, предлагая структурированный подход к поиску и подтверждению биомаркеров, что является ключевым для перехода от теоретических открытий к практическому применению.
Куда же дальше?
Представленная работа, несомненно, представляет собой шаг к преодолению разрыва между вычислительной патологией и клинической практикой. Однако, как и любая система, стремящаяся к долговечности, SAGE не избежит необходимости дальнейшего развития. Текущая архитектура, хотя и демонстрирует потенциал в генерации гипотез, все еще требует более глубокой интеграции с данными о пациентах в реальном времени и, что более важно, с пониманием механизмов, лежащих в основе выявленных биомаркеров. Поиск корреляции — это лишь начало; истинное понимание требует раскрытия причинно-следственных связей.
Следующим этапом представляется не просто увеличение масштаба системы, но и развитие её способности к самообучению и адаптации к меняющимся клиническим потребностям. Архитектура без истории — хрупка и скоротечна, поэтому необходимо обеспечить возможность сохранения и анализа эволюции знаний, накопленных системой. Каждая задержка в этом процессе — цена понимания, но и гарантия того, что система не станет просто очередным “черным ящиком”, выдающим результаты без объяснений.
В конечном счете, ценность SAGE, как и любой сложной системы, будет определяться не её технической сложностью, а её способностью улучшить жизнь пациентов. Это требует не только валидации биомаркеров, но и разработки новых терапевтических стратегий, основанных на этих знаниях. Все системы стареют — вопрос лишь в том, делают ли они это достойно.
Оригинал статьи: https://arxiv.org/pdf/2602.00953.pdf
Связаться с автором: https://www.linkedin.com/in/avetisyan/
Смотрите также:
- Искусственный интеллект: расшифровка паттернов инноваций
- Точность симуляций: Как правильно оценить истинные значения в причинно-следственных исследованиях
- Искусственный исследователь: Новые горизонты автономных агентов
- Время видеть: как агенты раскрывают многомерное мышление в языковых моделях.
- Квантовые игры: поиск равновесия на нейтральных атомах
- Адаптация моделей к новым данным: квантильная коррекция для нейросетей
- Сердце музыки: открытые модели для создания композиций
- Где «смотрят» большие языковые модели: новый взгляд на визуальное понимание
- Интеллектуальный поиск научных статей: новый подход к исследованию литературы
- Голос в переводе: как нейросети учатся понимать речь
2026-02-03 21:04