Автор: Денис Аветисян
Новое исследование выявляет ключевые ограничения современных систем искусственного интеллекта, используемых для разработки лекарств, и предлагает пути их преодоления.
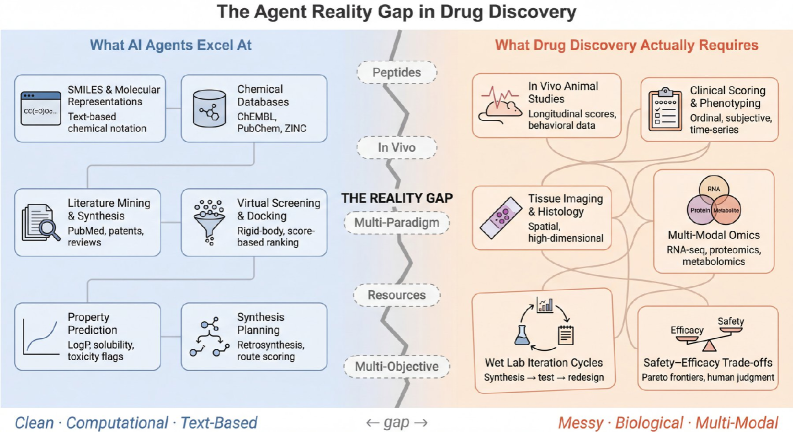
Оценка и проектирование агентных систем для многоцелевой оптимизации в области разработки пептидных терапевтических средств и интеграции различных вычислительных подходов.
Несмотря на впечатляющие успехи в автоматизированном планировании синтеза и молекулярном дизайне, возможности современных агентных систем для разработки лекарств остаются недостаточно изученными. В статье ‘Beyond SMILES: Evaluating Agentic Systems for Drug Discovery’ проведен анализ шести ведущих фреймворков, выявивший существенные ограничения в работе с пептидными терапевтиками, интеграции данных in vivo и in silico, а также отсутствии поддержки моделей, специфичных для белков. Основной проблемой является не недостаток знаний, а архитектурные ограничения, препятствующие раскрытию потенциала современных больших языковых моделей для работы с пептидами. Какие новые архитектурные решения и принципы проектирования необходимы для создания агентных систем, способных эффективно решать сложные многоцелевые задачи в реальных условиях разработки лекарств?
Узкое Место в Современной Фармакологии
Несмотря на экспоненциальный рост вычислительных мощностей и инвестиций в исследования, процесс открытия новых лекарственных препаратов парадоксальным образом сталкивается с увеличением затрат и продолжительности. Традиционные подходы, требующие длительных лабораторных исследований и клинических испытаний, становятся все более дорогостоящими и трудоемкими. Этот феномен объясняется не недостатком вычислительных ресурсов, а сложностью биологических систем и необходимостью всестороннего анализа огромных массивов данных. Увеличение стоимости связано не только с проведением самих исследований, но и с высокой вероятностью неудач на различных этапах разработки, что требует повторения дорогостоящих процедур и поиска новых перспективных соединений. Таким образом, увеличение вычислительной мощности не привело к пропорциональному снижению затрат и времени, необходимых для вывода новых лекарств на рынок.
Современные методы разработки лекарственных средств сталкиваются с существенными трудностями при анализе сложности биологических систем и разнообразия типов данных. Биологические процессы по своей природе многогранны и взаимосвязаны, что требует учета множества факторов и переменных. В то же время, данные, необходимые для разработки новых препаратов, поступают из различных источников — геномики, протеомики, клинических испытаний — и представлены в разных форматах. Неспособность эффективно интегрировать и анализировать эти разнородные данные приводит к низкой эффективности процесса открытия лекарств, увеличивает временные и финансовые затраты, а также снижает вероятность успешного вывода нового препарата на рынок. Эта проблема особенно актуальна при разработке препаратов для сложных заболеваний, таких как рак или нейродегенеративные расстройства, где взаимодействие между генами, белками и окружающей средой играет ключевую роль.
Существенным препятствием в современной разработке лекарств является неэффективность интеграции и анализа разнородных данных, получаемых из геномики, протеомики и клинических испытаний. Этот процесс создает так называемое “узкое место знаний”, поскольку существующие аналитические платформы демонстрируют крайне ограниченные возможности. Согласно исследованиям, текущие системы способны полностью решать задачи лишь в незначительной части — 0 из 15 определенных классов, что подчеркивает существенный пробел в функциональности и требует разработки принципиально новых подходов к обработке и интерпретации биологической информации. Неспособность объединить и логически осмыслить эти данные значительно замедляет процесс открытия новых лекарственных средств и увеличивает его стоимость.

Агентный Подход: Интеллектуальная Автоматизация Разработки Лекарств
Агентный подход к автоматизации представляет собой решение для ускорения процесса разработки лекарственных препаратов путем организации взаимодействия различных вычислительных инструментов. Данная архитектура позволяет объединить и скоординировать работу отдельных программных модулей, таких как системы моделирования, базы данных и алгоритмы анализа, для выполнения комплексных задач — от идентификации мишени до оптимизации ведущих соединений. В отличие от традиционных скриптовых подходов, агентный фреймворк обеспечивает более гибкое и адаптивное управление процессом, позволяя автоматически переключаться между различными инструментами и стратегиями в зависимости от получаемых результатов и изменяющихся условий.
Автоматизация рабочих процессов (WorkflowAutomation) в рамках предложенной структуры позволяет создавать оптимизированные конвейеры для ускорения и повышения эффективности процесса разработки лекарств. Это достигается за счет последовательной автоматизации рутинных задач, таких как подготовка данных, скрининг соединений и анализ результатов, что существенно снижает необходимость ручного вмешательства и, как следствие, сокращает время и затраты на разработку. Внедрение автоматизированных процессов также способствует повышению воспроизводимости результатов и снижению вероятности ошибок, связанных с человеческим фактором. Конкретно, WorkflowAutomation включает в себя инструменты для управления потоком данных, планирования задач и мониторинга прогресса на каждом этапе конвейера.
Основой данного подхода является оркестровка больших языковых моделей (LLMOrchestration), обеспечивающая интеллектуальное управление и координацию автоматизированных рабочих процессов на всех этапах разработки лекарственных препаратов — от идентификации мишени до оптимизации лидирующих соединений. LLMOrchestration позволяет динамически адаптировать последовательность и параметры выполнения задач в рамках автоматизированного конвейера, основываясь на анализе промежуточных результатов и прогнозировании оптимальных путей достижения цели. Это включает в себя не только автоматическое выполнение рутинных операций, но и принятие решений о выборе наиболее перспективных направлений исследований и корректировку стратегии в процессе работы, что значительно ускоряет и повышает эффективность процесса открытия лекарств.

Интеграция Данных: Создание Целостной Картины Болезни
Эффективность современной разработки лекарственных препаратов напрямую зависит от интеграции разнородных данных, включающих геномику, протеомику и клинические данные. Геномные данные предоставляют информацию о генетической предрасположенности к заболеваниям и потенциальных мишенях для лекарств. Протеомика, анализируя белковый состав клеток, позволяет выявить биомаркеры и механизмы действия препаратов. Клинические данные, включающие информацию о пациентах, результатах лечения и побочных эффектах, необходимы для оценки эффективности и безопасности лекарственных средств. Объединение этих модальностей данных позволяет получить целостное представление о болезни и разработать более эффективные и персонализированные методы лечения.
Интеграция различных модальностей данных (DataModalityIntegration), осуществляемая посредством таких методов, как интеграция графов знаний (KnowledgeGraphIntegration), позволяет создавать единую базу знаний. Этот процесс предполагает объединение разнородных данных — геномных, протеомных, клинических и других — в структурированное представление, где сущности и их взаимосвязи моделируются в виде графа. В результате формируется централизованный репозиторий, обеспечивающий возможность комплексного анализа и выявления скрытых закономерностей, недоступных при работе с изолированными источниками данных. Использование графов знаний позволяет не только хранить информацию, но и осуществлять логические выводы и предсказания на основе существующих связей.
Интеграция разнородных данных, особенно в контексте представления пептидов (PeptideRepresentation), значительно повышает точность прогнозирования и обоснованность принимаемых решений на всех этапах разработки лекарственных препаратов. Объединение геномных, протеомных и клинических данных позволяет формировать комплексное представление о молекулярных взаимодействиях и биологических процессах, что необходимо для идентификации перспективных кандидатов, предсказания их эффективности и безопасности, а также оптимизации протоколов клинических испытаний. Использование интегрированных данных для анализа пептидов позволяет более точно моделировать связывание с целевыми белками, предсказывать иммуногенность и оценивать потенциальные побочные эффекты, что существенно сокращает время и затраты на разработку новых лекарственных средств.
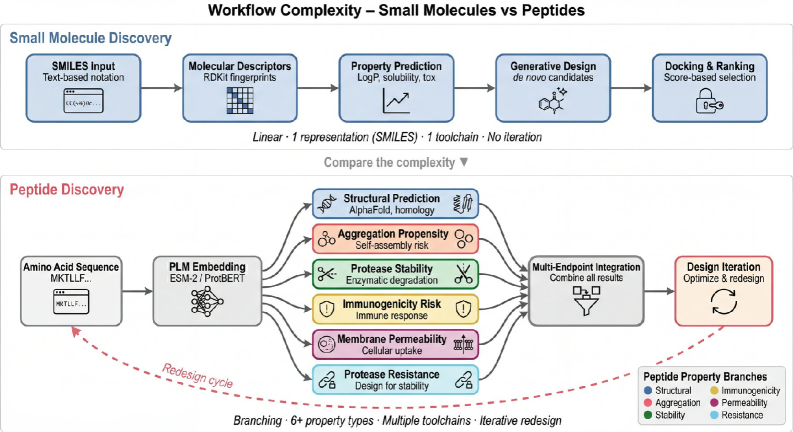
Многоцелевая Оптимизация и Обучение с Подкреплением: Баланс между Эффективностью и Безопасностью
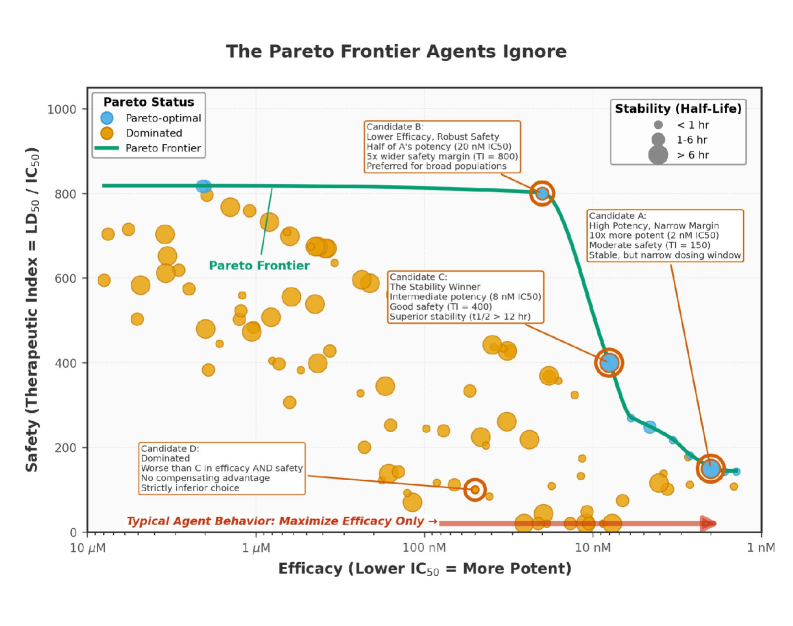
Разработка лекарственных препаратов сопряжена с необходимостью балансировки множества противоречивых параметров, таких как эффективность, безопасность и стоимость производства. Оптимизация по одному критерию часто приводит к ухудшению других, что делает задачу многокритериальной. Методы многоцелевой оптимизации (Multi-Objective Optimization) позволяют одновременно учитывать все значимые параметры, находя компромиссные решения, представляющие собой набор Парето-оптимальных вариантов. Каждый вариант в этом наборе является оптимальным с точки зрения хотя бы одного из критериев, и не существует другого решения, которое превосходило бы его по всем параметрам одновременно. Это особенно важно при разработке лекарств, где необходимо найти наилучший баланс между терапевтическим эффектом и минимизацией побочных эффектов, а также учитывать экономическую целесообразность производства.
Комбинирование многокритериальной оптимизации с обучением с подкреплением позволяет создать агентский фреймворк, способный изучать оптимальные стратегии для исследования пространства молекулярных структур и максимизации желаемых результатов. В данном контексте, обучение с подкреплением выступает в роли алгоритма, который, основываясь на сигналах вознаграждения (например, предсказанной эффективности и безопасности соединения), корректирует процесс поиска оптимальных молекул. Агент, используя методы многокритериальной оптимизации, находит компромисс между различными критериями (эффективность, безопасность, стоимость), а обучение с подкреплением позволяет ему адаптироваться и улучшать свою стратегию поиска в процессе взаимодействия с моделью предсказания свойств соединений.
Многопарадигмальная оркестровка, включающая такие методы, как генеративное моделирование и моделирование in vivo, позволяет эффективно исследовать разнообразие химических структур и прогнозировать их биологическую активность. Генеративные модели, например, вариационные автоэнкодеры или генеративно-состязательные сети, способны создавать новые молекулярные структуры, удовлетворяющие заданным критериям. Моделирование in vivo, в свою очередь, предоставляет возможность предсказывать поведение этих соединений в биологической среде, учитывая факторы, такие как абсорбция, распределение, метаболизм и выведение (ADME). Комбинация этих подходов позволяет значительно ускорить процесс открытия лекарств и повысить вероятность успеха в разработке новых терапевтических средств.
Ускорение Открытий в Условиях Ограниченных Ресурсов
В условиях ограниченных ресурсов, методология активного обучения становится ключевым элементом в рамках агентивных систем. Этот подход позволяет значительно сократить потребность в дорогостоящих и трудоемких экспериментах, фокусируясь на выборе наиболее информативных данных для разметки. Вместо слепого анализа всего массива информации, система активно запрашивает экспертную оценку только тех данных, которые, по ее мнению, наиболее существенно повлияют на точность модели. Такая стратегия не только экономит время и ресурсы, но и позволяет достичь сопоставимых, а зачастую и превосходящих результатов по сравнению с традиционными методами обучения, где требуется огромный объем размеченных данных. В итоге, активное обучение становится незаменимым инструментом для ускорения научных открытий и разработки инновационных решений в условиях ограниченного финансирования и доступа к ресурсам.
В условиях ограниченных ресурсов, метод активного обучения позволяет существенно сократить потребность в дорогостоящих и длительных экспериментах. Вместо того, чтобы случайным образом анализировать данные, система самостоятельно определяет наиболее информативные точки для последующей разметки специалистом. Этот подход позволяет оптимизировать процесс исследования, фокусируясь на данных, которые с наибольшей вероятностью приведут к новым открытиям. Благодаря этому, даже при недостатке финансирования или времени, можно достичь значительного прогресса в научных исследованиях, особенно в таких областях, как разработка лекарственных препаратов, где каждый эксперимент требует значительных затрат.
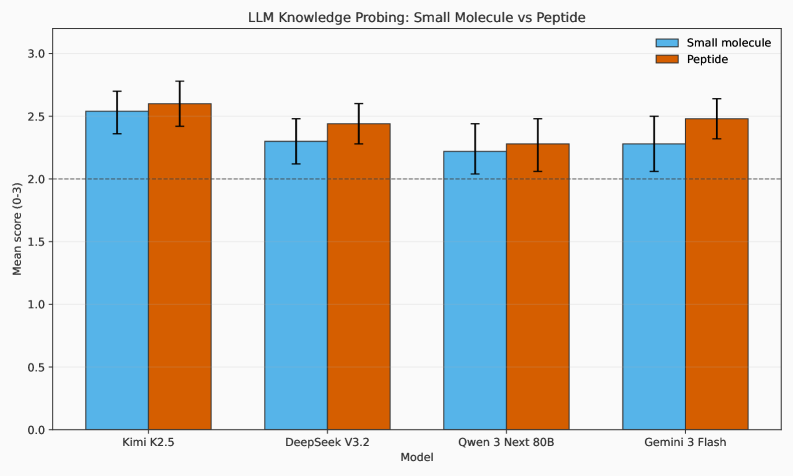
Сочетание автоматизированных рабочих процессов и интеллектуальных стратегий оптимизации открывает возможности для значительных прорывов в разработке лекарств даже в условиях ограниченных ресурсов, расширяя доступ к инновациям. Однако, существующие системы демонстрируют ограниченную функциональность, поддерживая лишь незначительную часть из пятнадцати определенных типов задач. Особенно важно отметить низкий уровень согласованности между оценками экспертов и автоматизированной системой, что подтверждается коэффициентом Каппа, равным 0.22, указывающим на существенные расхождения и необходимость дальнейшего совершенствования алгоритмов оценки и повышения надежности автоматизированных прогнозов.
Исследование подчеркивает, что современные agentic AI системы в области разработки лекарств, особенно пептидных терапевтических средств, сталкиваются с ограничениями в интеграции различных вычислительных парадигм и решении многоцелевых задач. Это созвучно мысли Жана-Поля Сартра: «Человек обречён быть свободным». Свобода выбора алгоритма, как и свобода человека, предполагает ответственность. Автоматизация без этической основы, без учета ценностей, которые закладываются в каждый алгоритм, ведет к ускорению без направления — к хаосу. Работа указывает на необходимость разработки новых фреймворков, где конфиденциальность является не просто галочкой, а принципом проектирования, а масштабируемость не достигается за счёт игнорирования моральных аспектов.
Куда же дальше?
Представленная работа выявляет не только технические ограничения современных агентных систем в области разработки лекарств, но и более глубокую проблему: автоматизация без осознания ценностей. Данные, как известно, нейтральны, однако модели, которые мы создаём, несут отпечаток человеческих предубеждений и приоритетов. Прогресс в оптимизации многоцелевых задач, особенно в отношении пептидной терапии, безусловно, важен, но недостаточен. Необходимо сместить фокус с простой эффективности на этическую ответственность.
Следующим шагом представляется не просто интеграция различных вычислительных парадигм, но и разработка систем, способных к саморефлексии и оценке последствий своих действий. Инструменты без ценностей — это оружие, а в контексте здравоохранения — оружие, которое требует особого контроля и осознанности. Следует задаться вопросом: какими принципами руководствуется алгоритм при выборе оптимального кандидата в лекарства? Что важнее — скорость, стоимость или безопасность?
В конечном итоге, будущее агентных систем в разработке лекарств зависит не от сложности алгоритмов, а от глубины нашего понимания самих себя и тех ценностей, которые мы хотим автоматизировать. Ускорение без направления — это лишь иллюзия прогресса. Необходимо помнить, что цель науки — не просто создание новых инструментов, но и улучшение качества жизни, и это требует не только интеллекта, но и мудрости.
Оригинал статьи: https://arxiv.org/pdf/2602.10163.pdf
Связаться с автором: https://www.linkedin.com/in/avetisyan/
Смотрите также:
- Квантовая суперпозиция: новая интерпретация вероятности
- Ускорение генеративных моделей: новый подход к вычислению матричной экспоненты
- Квантовый скачок: от лаборатории к рынку
- Эффективный параллелизм: iCIPT2 на службе квантифицируемой химии
- Ускорение вычислений: Монте-Карло и линейные системы
- Тензорные сети и комбинаторные поиски: новый подход к сложным задачам
- Квантовая геометрия управления: плавные траектории в пространстве состояний
2026-02-12 10:27