Автор: Денис Аветисян
Новая модель искусственного интеллекта позволяет экспертам-патологам с беспрецедентной точностью сегментировать изображения тканей и проводить количественный анализ для улучшения диагностики и прогнозирования заболеваний.
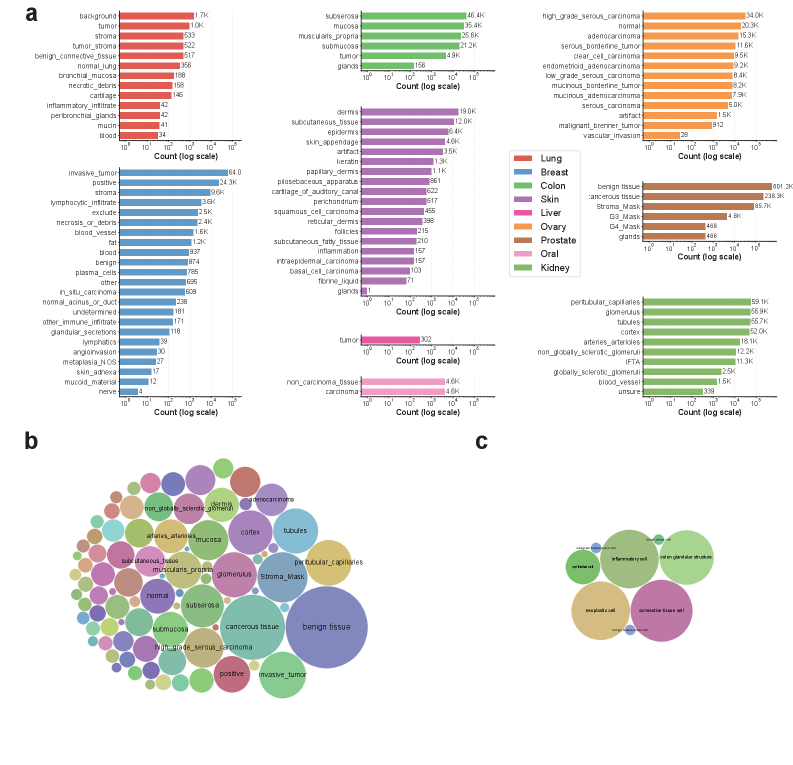
Представлена VISTA-PATH — интерактивная базовая модель для сегментации патологических изображений и количественного анализа, обеспечивающая экспертное уточнение и клинически значимый анализ тканей.
Несмотря на значительный прогресс в области сегментации гистопатологических изображений, существующие модели часто не учитывают специфику клинической интерпретации и возможности экспертного взаимодействия. В данной работе представлен ‘VISTA-PATH: An interactive foundation model for pathology image segmentation and quantitative analysis in computational pathology’ — интерактивная основа для сегментации, позволяющая учитывать визуальный контекст, семантическое описание тканей и экспертные подсказки для точного анализа гетерогенных патологических изображений. Разработанная модель, обученная на масштабном датасете VISTA-PATH Data, состоящем из более чем 1.6 миллиона триплетов изображение-маска-текст, превосходит существующие аналоги и поддерживает динамическую корректировку сегментации на основе экспертных аннотаций. Позволит ли VISTA-PATH значительно улучшить анализ микроокружения тканей и выявление прогностических биомаркеров для более точной диагностики и прогнозирования заболеваний?
Точность патоморфоза: Стремление к объективности
Традиционная патологическая оценка опухолей, несмотря на свою давнюю историю, часто оказывается подвержена субъективности интерпретации, что затрудняет точное прогнозирование исходов лечения. Опыт и взгляды разных патоморфологов могут значительно различаться при анализе гистологических препаратов, особенно в случаях сложных и неоднородных опухолей. Отсутствие количественных метрик и детализированного анализа структуры опухоли, включая размер, форму и распределение клеток, лишает врачей возможности выявлять тонкие, но критически важные признаки, предсказывающие реакцию на терапию и вероятность рецидива. Это приводит к тому, что пациенты с одинаковым диагнозом могут получать различное лечение, основанное не на объективных данных, а на субъективной оценке, что снижает эффективность персонализированной медицины и требует разработки более точных и воспроизводимых методов анализа опухолевой ткани.
Точное и воспроизводимое выделение границ опухоли является основополагающим для количественного анализа и персонализированной медицины. Определение границ опухоли — задача, требующая высокой степени точности, поскольку даже незначительные ошибки могут привести к неверной оценке размеров опухоли, стадии заболевания и, как следствие, к неоптимальному выбору терапевтической стратегии. Современные методы, использующие компьютерное зрение и машинное обучение, направлены на автоматизацию этого процесса, снижая субъективность и повышая надежность результатов. Возможность количественно оценить характеристики опухоли, такие как объем, плотность клеток и распределение биомаркеров, открывает перспективы для разработки индивидуальных планов лечения, учитывающих уникальные особенности каждого пациента и повышающих эффективность терапии. В перспективе, точная идентификация опухолевых регионов позволит более эффективно отслеживать динамику заболевания и своевременно корректировать лечение, что значительно улучшит прогноз для пациентов.
Существующие методы анализа опухолей часто сталкиваются с трудностями при оценке гетерогенности микроокружения опухоли и сложного взаимодействия между опухолевыми и стромальными клетками. Опухолевый микроклимат — это не однородная среда, а сложная мозаика, состоящая из различных типов клеток, молекул и внеклеточного матрикса. Неспособность точно отразить эту сложность приводит к неполному пониманию биологии опухоли и, как следствие, к неточным прогнозам относительно реакции пациента на лечение. Исследования показывают, что взаимодействие между опухолевыми клетками и клетками стромы — фибробластами, иммунными клетками, сосудистыми элементами — играет ключевую роль в росте, метастазировании и устойчивости к терапии. Поэтому, для разработки эффективных стратегий лечения, необходимо учитывать не только характеристики опухолевых клеток, но и особенности их взаимодействия с микроокружением, что требует разработки новых, более чувствительных и точных методов анализа.
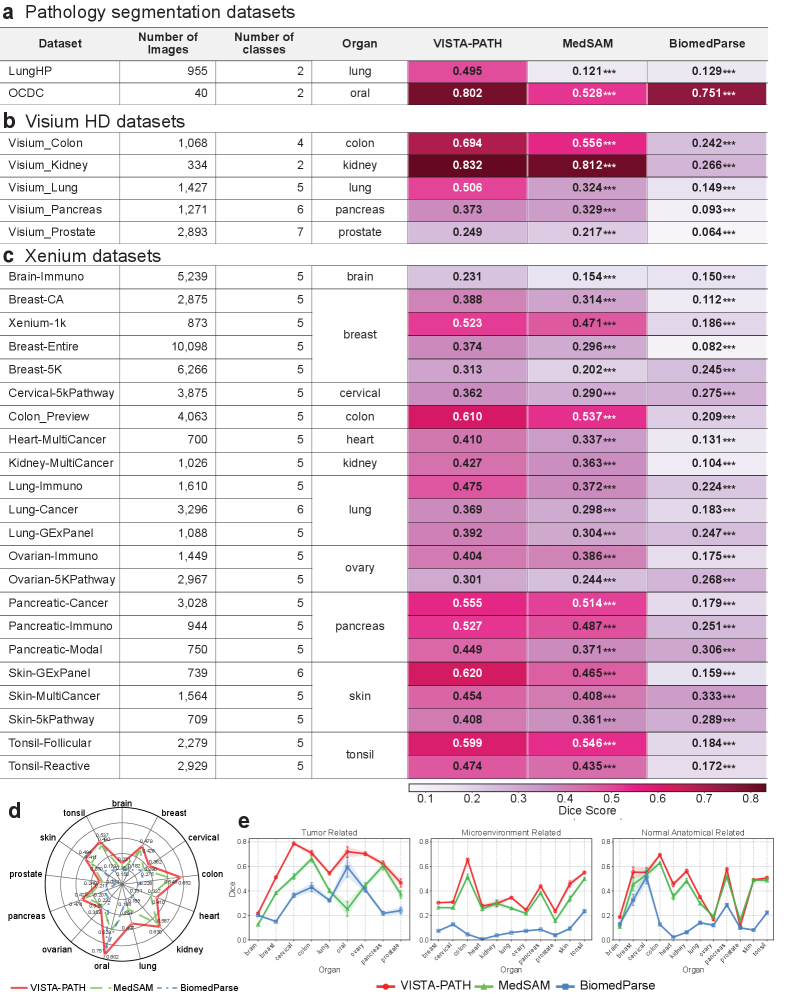
VISTA-PATH: Фундаментальная модель для сегментации патологических изображений
VISTA-PATH представляет собой новую базовую модель, разработанную специально для сегментации изображений в патологии. Отличительной особенностью является объединение возможностей автоматического анализа с возможностью экспертной корректировки результатов. Это достигается путем интеграции автоматической сегментации, выполняемой моделью, с инструментами, позволяющими патологоанатомам вносить необходимые уточнения и корректировки, что повышает точность и надежность анализа гистологических препаратов и других патологических изображений. Модель ориентирована на решение задач, требующих высокой точности и надежности, в частности, для диагностики и оценки степени злокачественности опухолей.
Модель VISTA-PATH использует механизм подсказок в виде ограничивающих прямоугольников (bounding box prompting) и перекрестного внимания (cross-attention) для повышения точности и эффективности сегментации изображений. Ограничивающие прямоугольники служат входными данными, определяющими область интереса, что позволяет модели сосредоточиться на релевантных участках изображения. Механизм перекрестного внимания позволяет модели динамически взвешивать различные части изображения при выполнении сегментации, выделяя наиболее значимые признаки для определения границ объектов и улучшения точности сегментации. Комбинация этих двух подходов позволяет VISTA-PATH эффективно обрабатывать сложные патологические изображения и обеспечивать высокую скорость и качество сегментации.
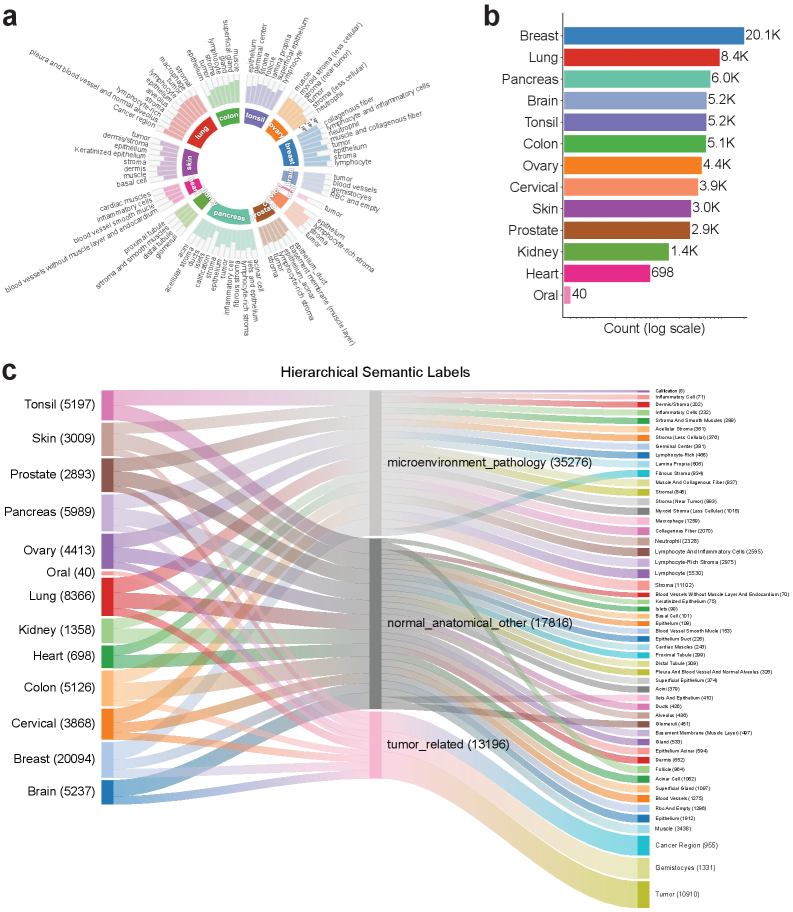
Модель VISTA-PATH обучалась на крупномасштабном наборе данных (VISTA-PATH Data), состоящем из более чем 1,6 миллиона троек: изображение — маска сегментации — текстовое описание. Такой объем данных позволяет модели демонстрировать высокую надежность и точность сегментации на разнообразных типах тканей. Наличие как изображений, так и соответствующих масок сегментации, а также текстовых аннотаций, обеспечивает комплексное обучение и позволяет модели обобщать знания для анализа новых, ранее не встречавшихся образцов тканей.
Модель VISTA-PATH построена на базе vision-language модели PLIP, что позволило использовать преимущества предварительно обученных представлений для анализа изображений. Использование подхода Segmentation Foundation Model (SFM) обеспечивает возможность переноса знаний (transfer learning) на новые задачи сегментации, снижая потребность в больших объемах размеченных данных и повышая обобщающую способность модели для различных типов тканей и патологий. SFM подход позволяет адаптировать модель к специфическим задачам сегментации, используя знания, полученные при обучении на обширном корпусе данных, и минимизируя необходимость полной переподготовки модели с нуля.
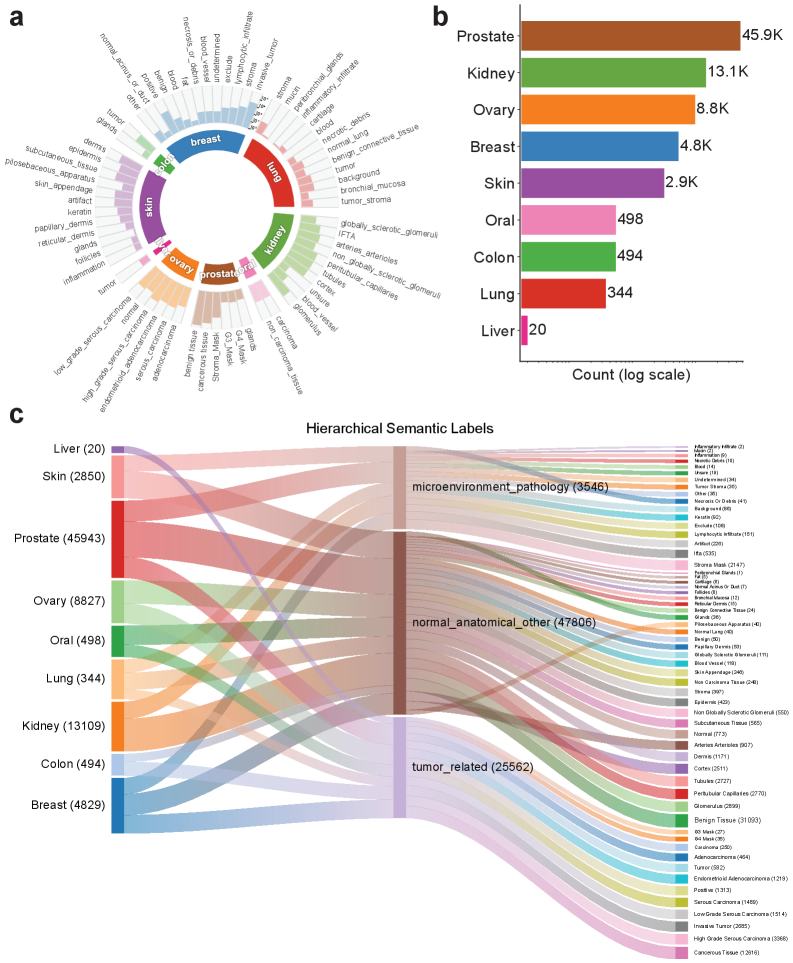
Показатель взаимодействия с тканью: Связь морфологии с прогнозом
Показатель взаимодействия с тканью (Tissue Interaction Score, TIS) представляет собой метрику, рассчитываемую на основе точной сегментации опухоли, выполняемой системой VISTA-PATH. TIS количественно оценивает степень плотности опухоли и характер ее взаимодействия с окружающей микросредой. Данный показатель вычисляется на основе анализа морфологических характеристик, позволяя оценить, насколько плотно опухолевые клетки упакованы и как они интегрированы в окружающие ткани. В частности, TIS учитывает соотношение площади опухоли к площади ее взаимодействия с окружающей стромой, предоставляя информацию о структуре и организации опухоли.
Точность оценки взаимодействия опухоли с окружающей тканью (Tissue Interaction Score, TIS) напрямую зависит от качества сегментации опухоли. Надёжное определение границ опухоли является критически важным, поскольку TIS рассчитывается на основе анализа плотности опухоли и её контакта с микроокружением. Неточности в сегментации, такие как ошибочное включение или исключение участков ткани, приводят к искажению результатов расчета TIS и, следовательно, к неверной оценке степени взаимодействия опухоли с окружающей средой. Высокая точность сегментации, обеспечиваемая платформой VISTA-PATH, является необходимым условием для получения достоверных значений TIS и использования его в качестве прогностического биомаркера.
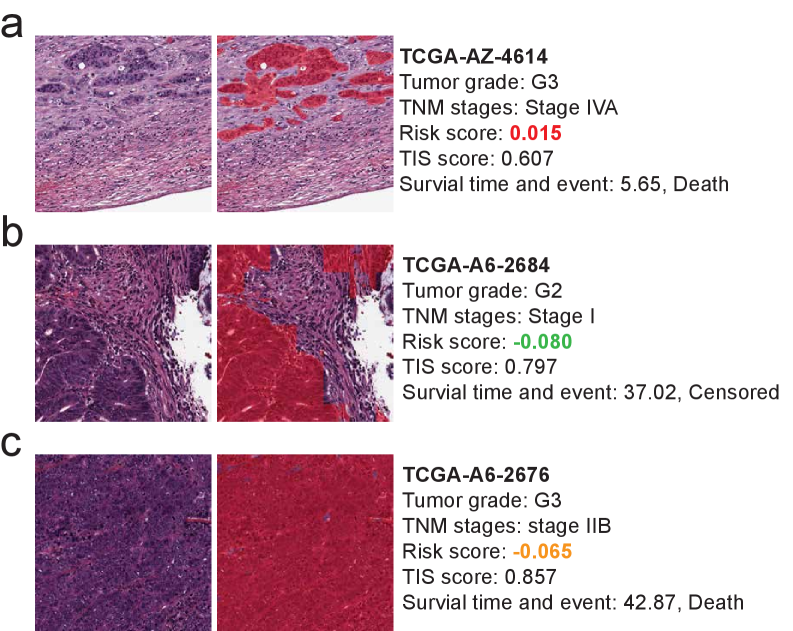
Анализ данных TCGA-COAD продемонстрировал значимую корреляцию между показателем Tissue Interaction Score (TIS) и исходами лечения пациентов с колоректальным раком. Применение TIS позволило улучшить прогностическую способность модели предсказания выживаемости на 16.8-20.7% по показателю C-index, по сравнению со стандартной моделью множественного обучения экземплярам. Данное улучшение указывает на потенциальную клиническую значимость TIS как прогностического биомаркера для оценки рисков и прогнозирования выживаемости у пациентов с колоректальным раком.
Внешняя валидация оценки взаимодействия с тканями (Tissue Interaction Score, TIS) с использованием данных пространственной транскриптомики подтверждает ее клиническую значимость в качестве прогностического биомаркера. Анализ данных пространственной транскриптомики, полученных из независимых когорт пациентов, показал, что TIS коррелирует с профилями экспрессии генов, связанными с иммунным ответом и микроокружением опухоли. Эти результаты подтверждают, что TIS не только отражает морфологические характеристики опухоли, но и тесно связано с биологическими процессами, влияющими на прогрессирование заболевания и выживаемость пациентов. Такое соответствие между морфологией, геномным профилем и клиническими исходами укрепляет позицию TIS как надежного инструмента для стратификации рисков и прогнозирования эффективности терапии.
За горизонтом прогноза: Будущее количественной патологии
Системы VISTA-PATH и TIS представляют собой инновационный подход к количественной патологии, позволяющий отойти от традиционных, субъективных оценок к объективному анализу, основанному на данных. Вместо полагания на визуальную интерпретацию, эти платформы извлекают из гистологических изображений измеримые параметры, такие как плотность клеток, морфология тканей и экспрессия биомаркеров. Это позволяет получить более точную и воспроизводимую оценку патологических изменений, открывая возможности для разработки более эффективных стратегий диагностики, прогнозирования течения заболеваний и подбора персонализированного лечения. Преимущество заключается в минимизации вариабельности, связанной с индивидуальным опытом патоморфолога, и обеспечении возможности объективного сравнения результатов исследований.
Современные методы количественной патологии, такие как VISTA-PATH и TIS, открывают принципиально новые перспективы в онкологии. Вместо традиционных, субъективных оценок, анализ теперь основывается на объективных, измеримых параметрах, полученных из изображений тканей. Это позволяет не только более точно диагностировать рак на ранних стадиях, но и предсказывать его развитие — прогностические возможности значительно расширяются. Более того, количественный анализ биомаркеров позволяет выявлять индивидуальные особенности опухоли, что, в свою очередь, способствует подбору наиболее эффективной стратегии лечения для каждого конкретного пациента. Такой подход к персонализированной медицине обещает не только повысить шансы на выздоровление, но и значительно улучшить качество жизни пациентов, столкнувшихся с онкологическими заболеваниями.
В дальнейшем исследования направлены на расширение сферы применения VISTA-PATH, выходя за рамки онкологии и охватывая другие заболевания, такие как нейродегенеративные расстройства и аутоиммунные патологии. Особое внимание уделяется интеграции Tissue Image Server (TIS) с другими клиническими данными, включая результаты генетических анализов и молекулярного профилирования опухолей. Такое объединение позволит создать комплексную картину заболевания, учитывающую не только морфологические характеристики тканей, но и индивидуальные особенности пациента, что, в свою очередь, откроет новые возможности для персонализированной медицины и повышения эффективности лечения. Ожидается, что подобный мультимодальный подход существенно улучшит точность диагностики и позволит прогнозировать ответ на терапию с большей уверенностью.
Сочетание передовых методов анализа изображений и количественно определяемых биомаркеров открывает принципиально новые перспективы для персонализированной медицины и улучшения результатов лечения пациентов. Вместо традиционных, субъективных оценок, этот подход позволяет проводить объективный, детальный анализ тканей на клеточном уровне, выявляя тонкие закономерности, которые могут указывать на прогноз заболевания или предсказывать ответ на терапию. Количественная оценка биомаркеров, полученная из анализа изображений, позволяет врачам принимать более обоснованные решения о выборе оптимального лечения для каждого конкретного пациента, максимизируя эффективность терапии и минимизируя побочные эффекты. Развитие данной области позволит перейти от эмпирического подхода к лечению к точному, основанному на данных, что значительно повысит шансы на успешное выздоровление и улучшит качество жизни пациентов.
Представленная работа демонстрирует стремление к математической чистоте в области анализа патологических изображений. Модель VISTA-PATH, предлагая интерактивную сегментацию, позволяет экспертам направлять процесс, обеспечивая не просто работоспособность, но и непротиворечивость результатов. Как отметил Эндрю Ын: «Мы должны стремиться к созданию систем, которые не просто работают, но и обладают внутренней логикой и доказуемостью». Подобный подход к сегментации тканей, акцентирующий внимание на точности и возможности экспертной коррекции, соответствует принципу доказательства корректности алгоритма, а не полагаться лишь на успешное прохождение тестов. Данная модель, фокусируясь на клинически значимом анализе тканей, подтверждает важность математической основы в практическом применении.
Что Дальше?
Представленная работа, безусловно, является шагом вперёд в автоматизированном анализе патологических изображений. Однако, стоит признать, что истинная элегантность алгоритма проявляется не в его способности «работать» на наборе данных, а в его математической доказуемости. VISTA-PATH демонстрирует потенциал интерактивной сегментации, но вопрос о робастности модели к вариациям в протоколах окраски тканей и качеству изображения остаётся открытым. В конечном счёте, любой алгоритм, не учитывающий фундаментальные принципы получения изображения, обречён на ошибки.
Перспективы, очевидно, лежат в области разработки более строгих математических моделей, способных учитывать физические процессы, происходящие при формировании изображения. Использование принципов информативной теории и байесовского вывода позволит не просто сегментировать ткань, но и оценивать достоверность полученных результатов. Необходимо помнить, что количественная оценка — это не самоцель, а инструмент для понимания биологических процессов, и лишь математическая дисциплина способна обеспечить надёжность этого инструмента.
В хаосе данных спасает только математическая дисциплина. Дальнейшие исследования должны быть направлены на создание систем, способных не только обнаруживать изменения в ткани, но и предсказывать их развитие, основываясь на строгих математических моделях. В противном случае, мы рискуем получить лишь ещё один «чёрный ящик», способный выдавать статистически значимые, но лишенные физического смысла результаты.
Оригинал статьи: https://arxiv.org/pdf/2601.16451.pdf
Связаться с автором: https://www.linkedin.com/in/avetisyan/
Смотрите также:
- Сердце музыки: открытые модели для создания композиций
- Эмоциональный отпечаток: Как мы научили ИИ читать душу (и почему рейтинги вам врут)
- Квантовый скачок из Андхра-Прадеш: что это значит?
- LLM: математика — предел возможностей.
- Волны звука под контролем нейросети: моделирование и инверсия в вязкоупругой среде
- Почему ваш Steam — патологический лжец, и как мы научили компьютер читать между строк
2026-01-27 03:50