Автор: Денис Аветисян
Обзор демонстрирует, как высокоточные модели на основе клеточных агентов открывают новые возможности для понимания сложных биологических процессов и разработки биоинженерных решений.

В статье рассматривается Deformable Cell Model — подход к моделированию поведения клеток и организации тканей, позволяющий глубже изучать механику клеток, формирование органоидов и поведение многоклеточных систем.
Понимание физического взаимодействия клеток и их микросреды остается сложной задачей в изучении организации живых тканей. В настоящей работе, посвященной теме ‘How high-resolution agent-based models can improve fundamental insights in tissue development and cell culturing methods’, рассматривается класс клеточных моделей — так называемые деформируемые клеточные модели (DCM), позволяющие с высокой степенью реализма моделировать биофизику клеток. Показано, что данный подход, основанный на агентном моделировании, способен генерировать количественно оценимые результаты в биологических и биотехнологических задачах, включая моделирование формирования органоидов и культивирования клеток. Какие перспективы открывает дальнейшее развитие и применение DCM для изучения сложных многоклеточных систем и разработки новых биоинженерных решений?
Преодолевая Упрощения: Ограничения Двумерного Культивирования
Традиционное двумерное культивирование клеток, несмотря на свою распространенность, не способно адекватно воссоздать сложную трехмерную микросреду, характерную для живых тканей. Клетки в организме не растут на плоской поверхности, а взаимодействуют с окружающим матриксом, другими клетками и разнообразными биохимическими сигналами. Отсутствие этих факторов в 2D-культуре приводит к изменениям в морфологии клеток, их экспрессии генов и функциональной активности, что существенно искажает результаты исследований. Это, в свою очередь, ограничивает достоверность данных, полученных в лабораторных условиях, и снижает прогностическую ценность экспериментов, особенно в контексте изучения сложных биологических процессов и разработки новых лекарственных препаратов. Таким образом, несоответствие между упрощенной 2D-средой и реальной тканевой организацией представляет собой серьезную проблему для точного моделирования биологических систем.
Ограниченная физиологическая релевантность традиционных двумерных клеточных культур существенно снижает прогностическую ценность экспериментов in vitro и скрининга лекарственных препаратов. Дело в том, что упрощенная среда культивирования не отражает сложность трехмерной структуры тканей и межклеточных взаимодействий, что приводит к несоответствию между результатами, полученными в лаборатории, и реакцией организма in vivo. В частности, ответ клеток на лекарственные вещества, их метаболизм и токсичность могут значительно отличаться в упрощенных условиях, что ведет к ложноположительным или ложноотрицательным результатам, и, как следствие, к неудачным клиническим испытаниям. Таким образом, необходимость разработки более реалистичных моделей, имитирующих физиологическую микросреду, становится критически важной для повышения эффективности разработки новых лекарственных препаратов и понимания механизмов заболеваний.
Для более глубокого понимания клеточных процессов и повышения достоверности лабораторных исследований необходимы усовершенствованные модели, превосходящие упрощенные двухмерные культуры. Традиционные методы часто не учитывают сложную трехмерную структуру тканей, межклеточные взаимодействия и влияние микроокружения, что ограничивает их способность адекватно отражать физиологическую реальность. Современные исследования активно разрабатывают и внедряют трехмерные клеточные культуры, органоиды и микрофлюидные системы, позволяющие воссоздать более реалистичные условия для изучения клеточного поведения, дифференцировки и ответа на внешние стимулы. Эти инновационные подходы открывают новые возможности для разработки лекарственных препаратов, изучения механизмов заболеваний и персонализированной медицины, поскольку позволяют проводить исследования в контексте, максимально приближенном к естественной среде обитания клеток.
Деформируемые Модели: Точный Расчет Клеточной Механики
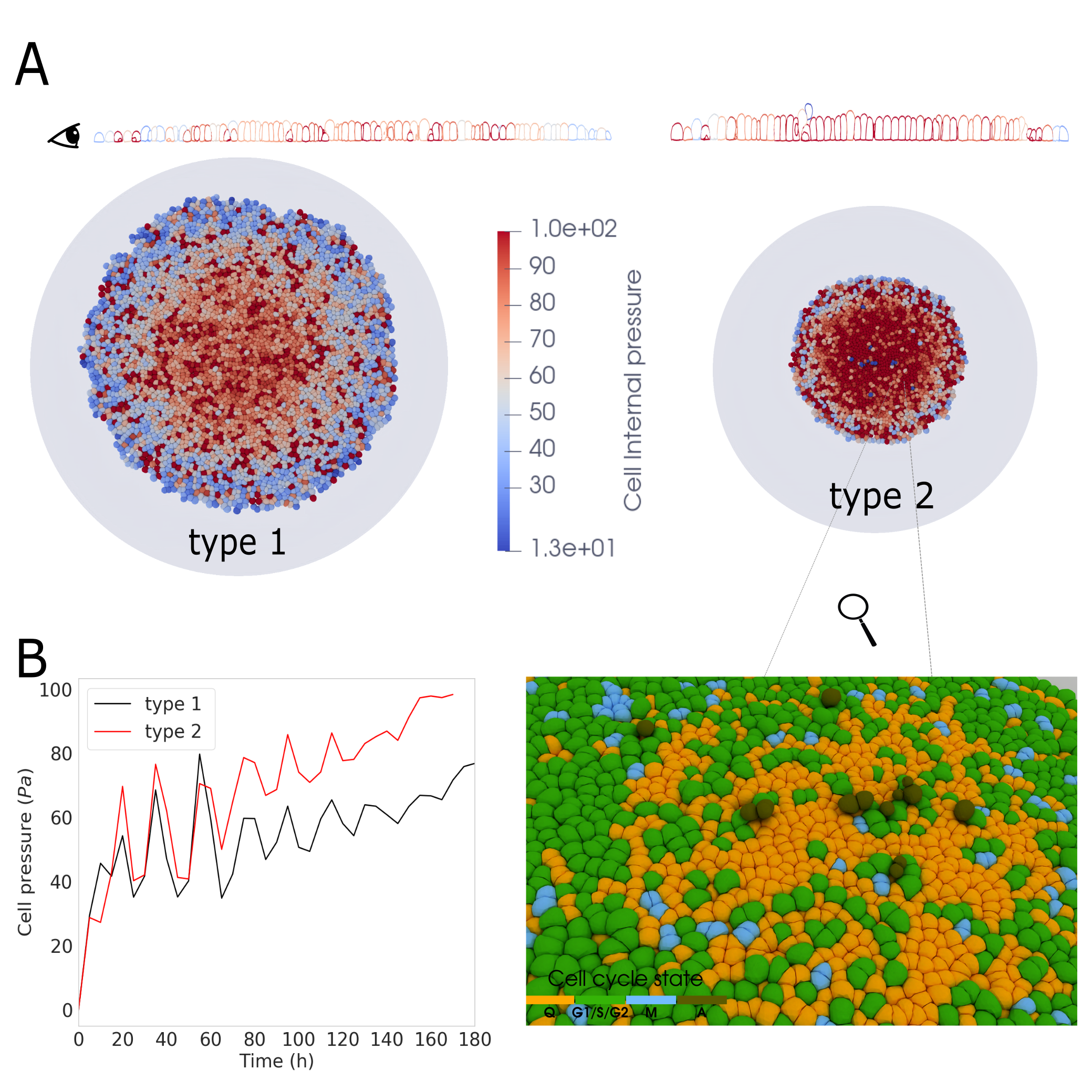
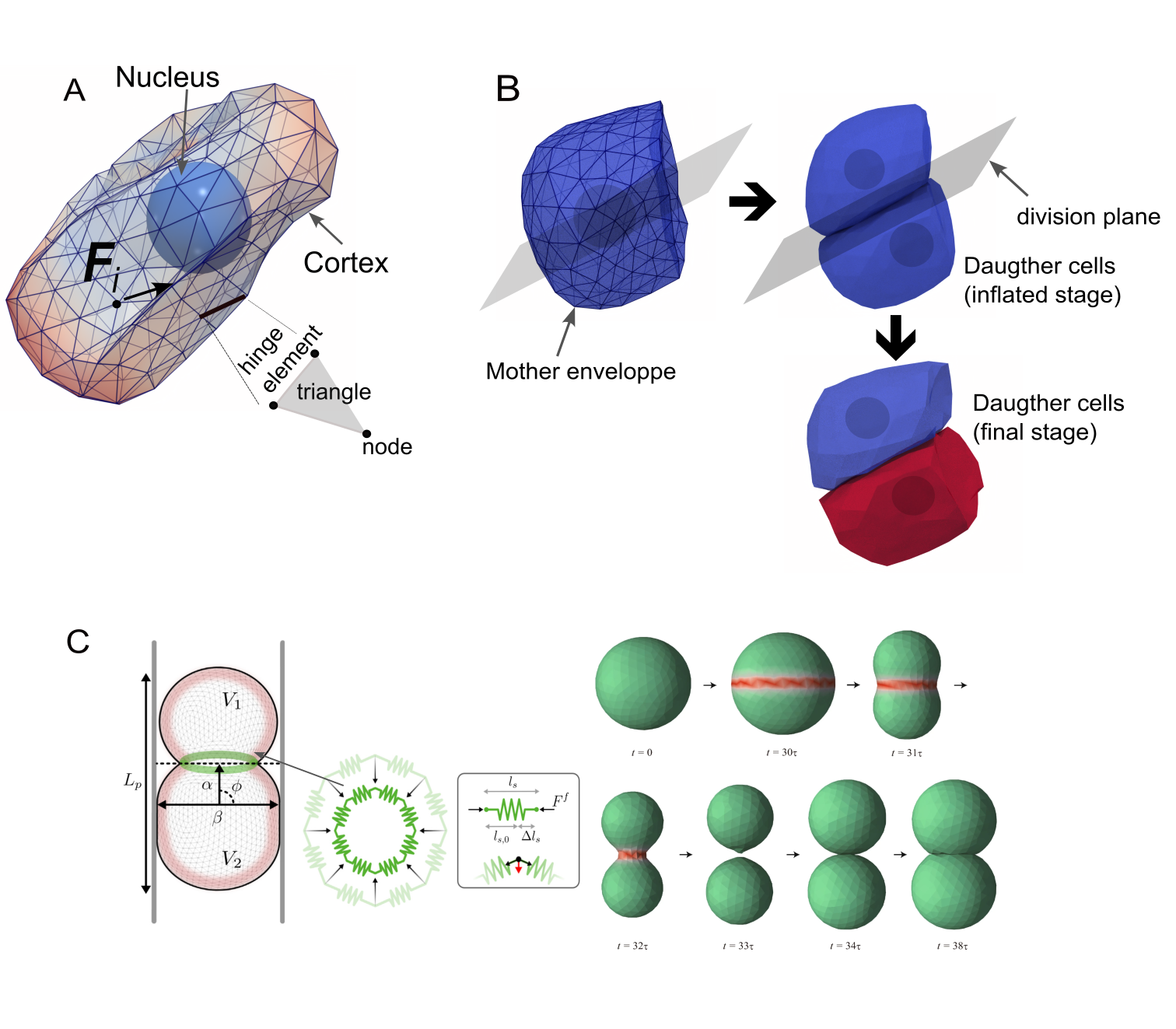
Деформируемые клеточные модели (ДКМ) представляют собой мощную вычислительную платформу для моделирования клеточной механики и поведения с высокой точностью. В основе ДКМ лежит численное решение уравнений, описывающих деформацию клеточной мембраны и внутренние силы, такие как осмотическое давление и поверхностное натяжение. Модели позволяют учитывать сложные геометрические формы клеток и их взаимодействие с окружающей средой, включая межклеточные адгезии и внешние механические воздействия. Вычислительная эффективность ДКМ позволяет проводить симуляции, включающие значительное количество клеток и узлов, что необходимо для изучения сложных биологических процессов, таких как формирование тканей и миграция клеток.
Деформируемые клеточные модели (DCM) предсказывают форму, движение и взаимодействия клеток за счет интеграции фундаментальных физических принципов. В частности, моделирование осмотического давления, отражающего разницу в концентрациях растворенных веществ между клеткой и внешней средой, обеспечивает реалистичное представление изменений объема клетки. Натяжение кортекса, обусловленное актиновым цитоскелетом, определяет устойчивость формы клетки и ее способность противостоять деформациям. Взаимодействие клеток посредством адгезии, моделируемое как силы притяжения между клеточными мембранами, позволяет DCM воспроизводить процессы формирования тканей и клеточного скопления. Точное описание этих физических факторов позволяет DCM предсказывать поведение клеток в различных биологических сценариях.
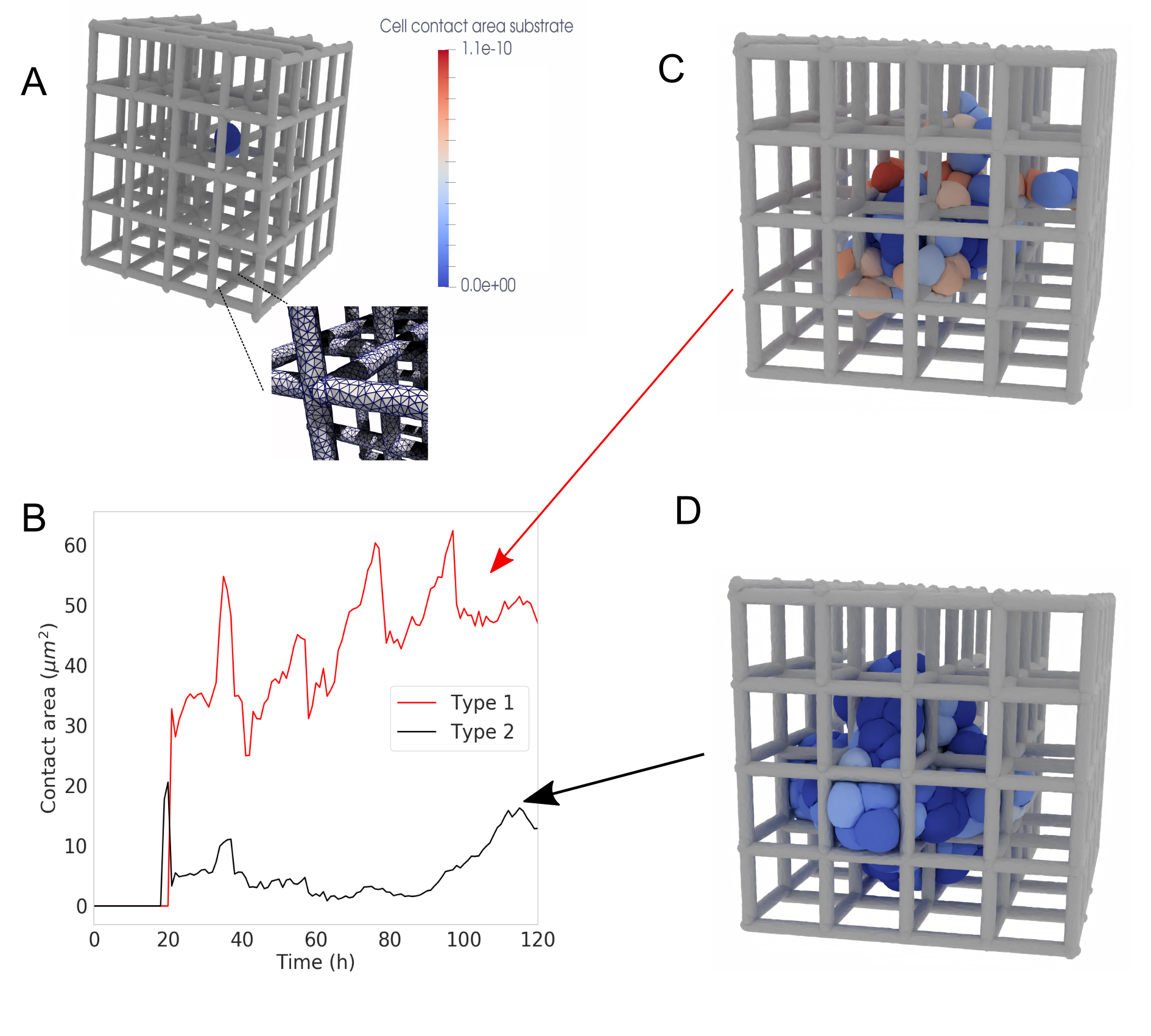
В симуляциях формирования желчных канальцев (bile canaliculi) деформируемые клеточные модели (DCM) достигли детализации до 2600 узлов на клетку. Такая высокая разрешающая способность позволяет проводить детальный анализ бифизических механизмов, определяющих процесс формирования канальцев, включая влияние клеточного давления, межклеточного взаимодействия и деформации клеточной мембраны. Использование столь большого количества узлов обеспечивает точное представление сложной геометрии клеток и позволяет моделировать динамику клеточного скелета и его вклад в формирование структуры желчных канальцев. Данный уровень детализации необходим для изучения влияния различных факторов на процесс формирования канальцев и для разработки новых терапевтических стратегий.
Высокая точность деформируемых клеточных моделей (DCM) позволяет проводить качественное сравнение результатов моделирования с экспериментальными изображениями формирования желчных канальцев. В частности, проведенные симуляции демонстрируют структурное сходство с наблюдаемыми в экспериментах образцами формирования канальцев, подтверждая адекватность моделирования бифизических процессов. Визуальное соответствие между смоделированными и экспериментально полученными структурами служит валидацией модели и подтверждает ее способность реалистично воспроизводить морфологические аспекты формирования желчных канальцев.
Агент-Ориентированные Модели: Масштабируемость через Абстракцию
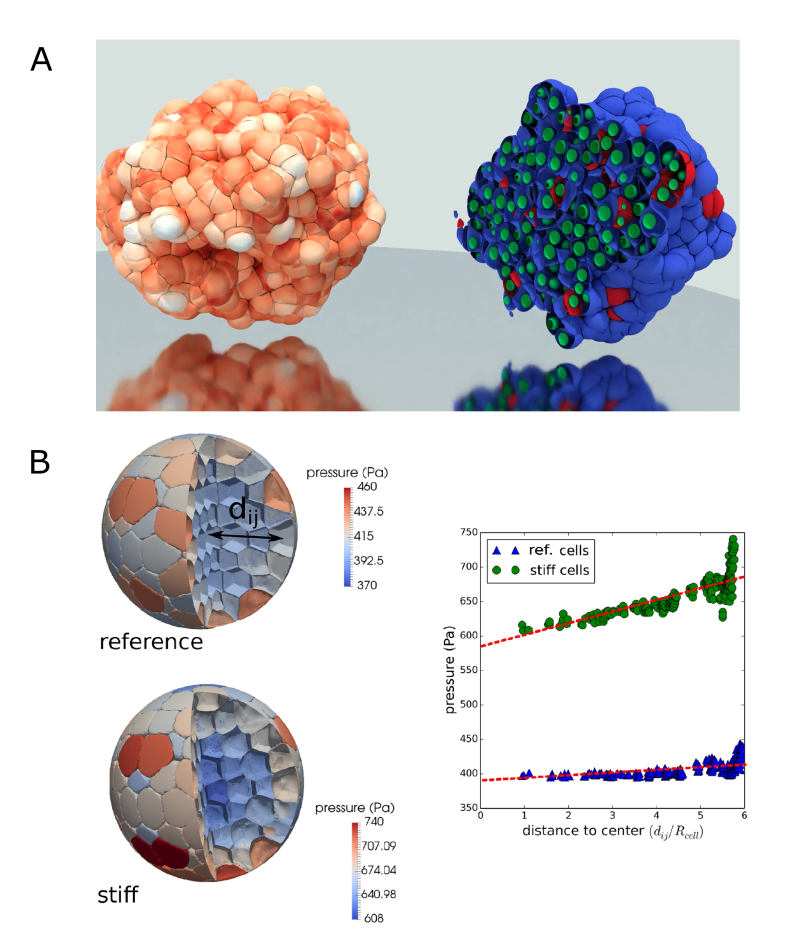
Агент-ориентированные модели (АОМ) представляют собой вычислительно эффективную альтернативу моделям, основанным на дифференциальных уравнениях (МОДУ), за счет представления клеток как индивидуальных агентов, взаимодействующих в определенной среде. В отличие от МОДУ, требующих решения сложных систем уравнений для каждой точки в пространстве, АОМ моделируют поведение каждой клетки как отдельного объекта с определенными правилами взаимодействия с соседними клетками и окружающей средой. Это позволяет снизить вычислительную сложность, особенно при моделировании больших популяций клеток и сложных пространственных структур, поскольку вычисления выполняются только для отдельных агентов, а не для всего пространства. Каждый агент имеет свои атрибуты и поведение, определяющие его реакции на внешние стимулы и взаимодействия с другими агентами, что позволяет моделировать эмерджентные свойства, возникающие из коллективного поведения клеток.
Различные подходы к агент-ориентированному моделированию (ABM), такие как модели вершин (Vertex Models), клеточные модели Поттса (Cellular Potts Models) и методы субклеточных элементов (Subcellular Element Methods), отличаются уровнем детализации и вычислительными затратами. Модели вершин, представляющие клетки как многоугольники, обеспечивают точное описание формы, но требуют значительных вычислительных ресурсов. Модели клеточного Поттса, основанные на энергии, снижают вычислительную сложность, но упрощают представление клеточной морфологии. Методы субклеточных элементов, моделирующие отдельные органеллы, предлагают наиболее детальное представление, но являются наиболее ресурсоемкими. Выбор конкретного подхода зависит от компромисса между необходимой точностью и доступными вычислительными мощностями.
Программный пакет TiSim предоставляет инструменты для реализации и выполнения сложных агент-ориентированных моделей, позволяя проводить крупномасштабные исследования поведения клеток. TiSim обеспечивает поддержку различных подходов, включая Vertex Models, Cellular Potts Models и Subcellular Element Methods, и оптимизирован для эффективной обработки большого количества агентов и их взаимодействий. Платформа включает в себя инструменты для определения геометрии, задания правил поведения агентов, сбора и анализа данных, что позволяет моделировать сложные биологические процессы и исследовать влияние различных параметров на поведение клеточных популяций. Возможности TiSim позволяют проводить симуляции, включающие десятки миллионов агентов, что существенно расширяет возможности моделирования по сравнению с традиционными подходами.
Повышение Прогностической Ценности: Интеграция Симуляций и Пространственных Данных
Для значительного снижения вычислительных затрат без потери прогностической точности, активно используются суррогатные модели. Эти модели, обученные на данных, полученных в результате работы более сложных вычислительных моделей, позволяют аппроксимировать их выходные данные с гораздо меньшими ресурсами. Вместо трудоемких расчетов, суррогатные модели, такие как полиномиальные регрессии или нейронные сети, предоставляют быстрые и точные предсказания, что особенно важно при решении задач, требующих многократных вычислений или анализа больших объемов данных. Такой подход открывает возможности для моделирования сложных биологических процессов, которые ранее были недоступны из-за ограничений в вычислительной мощности, позволяя исследователям проводить более детальные и эффективные исследования.
Сочетание упрощенных моделей, полученных на основе результатов сложных вычислений, с данными пространственной геномики открывает возможности для создания симуляций, учитывающих неоднородность биологических тканей. Этот подход позволяет моделировать распределение различных молекул и клеточных состояний непосредственно в ткани, а не усредненные показатели. Благодаря интеграции данных о пространственном расположении генов и белков с результатами моделирования, удается получить более точное и детализированное представление о функционировании ткани, учитывающее локальные различия в ее структуре и составе. В результате, становится возможным исследовать, как пространственная организация влияет на клеточное поведение, развитие заболеваний и реакцию на лекарственные препараты, приближаясь к более полному пониманию сложных биологических процессов.
Интеграция суррогатных моделей с данными пространственной геномики открывает принципиально новые возможности для изучения биологических систем. Такой подход позволяет не просто предсказывать общие тенденции, но и детально исследовать сложные процессы, такие как развитие тканей, прогрессирование заболеваний и реакция на лекарственные препараты, учитывая их пространственную гетерогенность. Вместо анализа усредненных данных, исследователи получают возможность наблюдать, как различные участки ткани взаимодействуют друг с другом, как изменения в одном месте влияют на другие, и как эти взаимодействия меняются во времени. Это обеспечивает более полное и реалистичное понимание биологических явлений, позволяя разрабатывать более эффективные стратегии лечения и профилактики заболеваний, а также предсказывать индивидуальную реакцию организма на терапевтическое вмешательство.
Разработанная платформа стремится к достижению времени моделирования, меньшего, чем время проведения фактического эксперимента. Это критически важно для создания “цифрового двойника” в биоинженерии — виртуальной копии биологической системы, позволяющей проводить многочисленные исследования и тестирования in silico, значительно сокращая затраты и время, необходимые для традиционных лабораторных методов. Такой подход открывает возможности для предсказания реакции тканей на различные воздействия, оптимизации протоколов лечения и разработки новых биоматериалов, позволяя исследователям изучать сложные биологические процессы с беспрецедентной скоростью и точностью. По сути, платформа призвана преодолеть разрыв между вычислительным моделированием и экспериментальной биологией, создавая основу для персонализированной медицины и прорывных биоинженерных решений.
Исследование, представленное в статье, демонстрирует потенциал агентного моделирования для углубленного понимания сложных биологических процессов, в частности, формирования тканей и поведения клеток. Этот подход, акцентирующий внимание на индивидуальных агентах и их взаимодействии, позволяет исследовать механизмы, лежащие в основе организации многоклеточных систем. Как однажды заметила Мария Кюри: «Я не верю в счастье. Я верю в работу». Эта фраза отражает суть научного поиска — стремление к познанию через упорный труд и анализ, подобно тому, как DCM позволяет детально исследовать поведение клеток и их взаимодействие, раскрывая закономерности, скрытые от простого наблюдения. Моделирование, подобно эксперименту, требует точности и систематичности, что в конечном итоге ведет к новым открытиям и пониманию фундаментальных принципов жизни.
Куда же дальше?
Рассмотренная в данной работе модель деформируемой клетки, безусловно, представляет собой шаг вперед в симуляции многоклеточных систем. Однако, если приглядеться внимательнее, становится очевидно: модель пока что лишь отражает, а не предсказывает. Способность воспроизводить наблюдаемое — это хорошо, но где гарантия, что «баг» в симуляции — не сигнал о неизвестном биологическом механизме? Где исследование пределов адекватности самой модели, её неспособности учесть факторы, лежащие за пределами текущего понимания?
Очевидным направлением является интеграция с данными, полученными методами, которые пока что кажутся несовместимыми — например, с данными протеомики или метаболомики. Но интереснее выглядит вопрос о создании моделей, способных к самообучению и адаптации, моделей, которые сами формулируют гипотезы и проверяют их на симулируемых тканях. Если рассматривать симуляцию как форму реверс-инжиниринга биологической реальности, то необходимо стремиться к созданию систем, способных к «взлому» этой реальности, к выявлению скрытых закономерностей, которые остаются незамеченными при традиционном подходе.
В конечном счете, ценность модели определяется не её способностью точно воспроизводить существующие данные, а её способностью генерировать новые, неожиданные предсказания, которые можно проверить экспериментально. Иначе это всего лишь красивая визуализация, а не инструмент для истинного понимания.
Оригинал статьи: https://arxiv.org/pdf/2601.15273.pdf
Связаться с автором: https://www.linkedin.com/in/avetisyan/
Смотрите также:
- Сердце музыки: открытые модели для создания композиций
- Эмоциональный отпечаток: Как мы научили ИИ читать душу (и почему рейтинги вам врут)
- Почему ваш Steam — патологический лжец, и как мы научили компьютер читать между строк
- Квантовый скачок из Андхра-Прадеш: что это значит?
- LLM: математика — предел возможностей.
- Волны звука под контролем нейросети: моделирование и инверсия в вязкоупругой среде
- Динамическая теория поля в реальном времени: путь к квантовым вычислениям
2026-01-22 21:15